临床前小鼠模型在新抗癌药物的药物发现和开发过程中至关重要。这些小鼠模型有不同的类型,如同基因小鼠模型、基因工程小鼠模型 (GEMM)、细胞系来源的异种移植物 (CDX) 和患者来源的异种移植物 (PDX)。每种癌症小鼠模型都有其优点和缺点,小鼠模型的选择取决于您想要实现的目标。尽管存在差异,这些小鼠模型为我们提供了丰富的信息,帮助我们更好地掌握癌症病理学并预测治疗的效果。
同基因小鼠模型
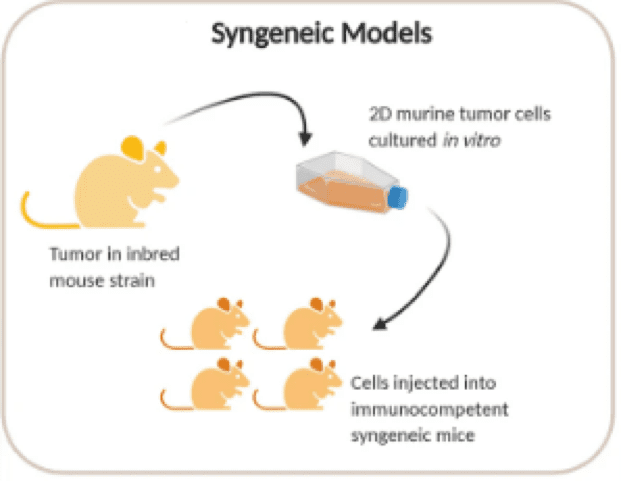
通过移植小鼠来源的肿瘤细胞系产生的同基因小鼠模型
同基因小鼠模型是最早用于肿瘤学疗效研究。这些模型涉及将永生化小鼠癌细胞系的同种异体移植物移植到来自同一近交系的免疫活性小鼠中。由于同源小鼠肿瘤与其宿主具有免疫相容性,因此可以最大限度地减少免疫排斥并允许肿瘤生长。
由于其完整的小鼠免疫系统,同基因小鼠模型对于概念验证免疫肿瘤学研究特别有吸引力。它们具有成本效益且易于生成,因为细胞系可以在任何实验室中轻松培养和扩增。宿主小鼠很容易获得,肿瘤移植率通常为 100%,并且可以用每组具有统计学意义的数量的小鼠进行研究。
已开发出多种用于同基因模型的小鼠细胞系,主要是在 C57BL/6 和 BALB/c 背景中。这些细胞系可以进行广泛的表征,包括生长数据、药物敏感性、RNA 测序和其他因素,使研究人员能够根据其具体特征选择合适的模型。
同基因小鼠模型越来越多地用于组合研究,特别是在检查站封锁或治疗干预的调查。研究人员可以对小鼠进行基因改造,使其表达人源化免疫检查点分子(例如 PD1、CTLA-4)。相反,同基因细胞系可以被设计为表达特定因子,例如检查点抑制剂,这有助于评估免疫检查点药物的功效。工程同基因细胞系提供了扩展的人源化靶标范围,以更好地研究药物靶标并探索生物作用机制。
基因工程小鼠模型 (GEMM)
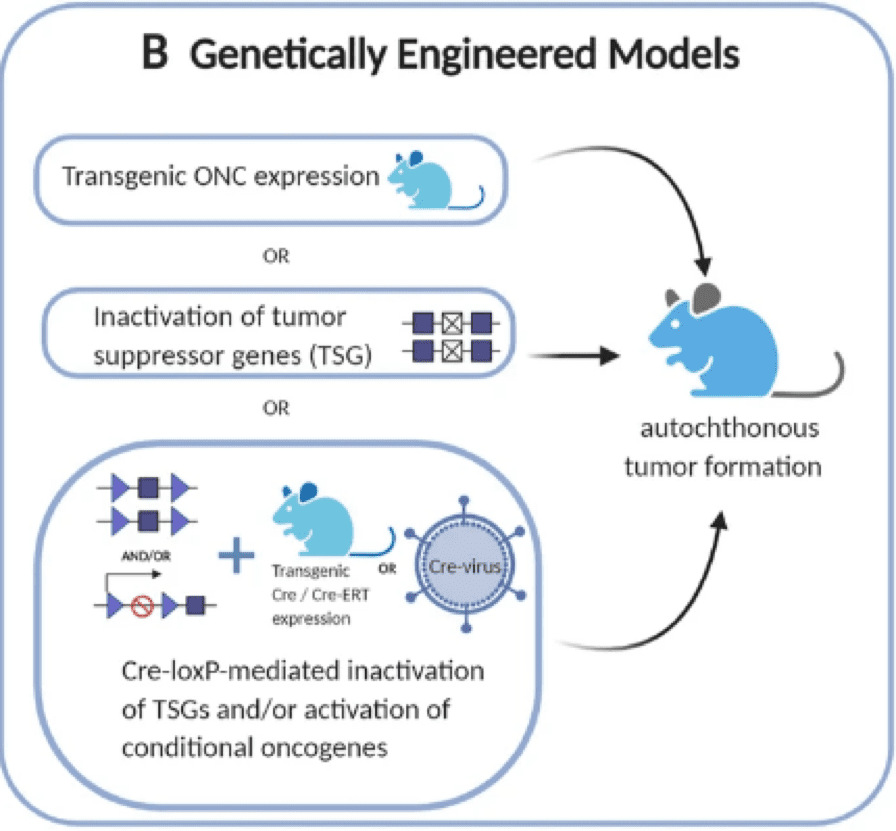
GEMM 通过激活或灭活癌基因/肿瘤抑制因子来促进自发肿瘤的发展
基因工程小鼠模型 (GEMM) 具有免疫功能的小鼠,经过改造发展特定类型的癌症。这些模型是通过将已知与人类癌症相关的基因突变或改变引入小鼠而创建的。GEMM 可以准确、稳健地从解剖学、组织病理学和遗传学方面重现原发性癌症,因为它们保留了肿瘤微环境,包括免疫、血管和基质室。它们还提供对肿瘤发生的遗传学和动力学的精确控制。因此,它们在 了解肿瘤的发生和进展.
尽管 GEMM 能够更好地预测临床反应,但将其集成到药物开发工作流程中会带来挑战。一个限制是实验研究持续时间较长,因为在治疗干预之前肿瘤可能需要 2-10 个月才能达到适当的大小。此外,由于菌落的产生以及基因分型和育种的维护成本,它是费力且昂贵的。GEMM 还可能表现出由用于开发它们的方法的内在特性引起的不可预测的突变(由于“脱靶效应”),并可能产生胚胎致死表型。尽管存在这些挑战,利用 CRISPR/Cas9 技术进行基因组工程的最新进展使研究人员更容易使用 GEMM。
细胞系衍生异种移植 (CDX) 模型
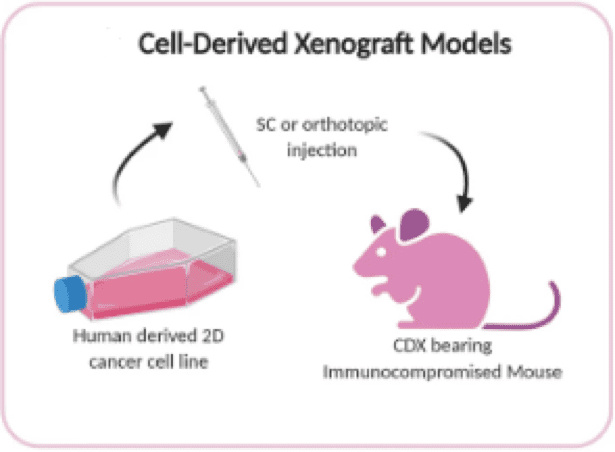
CDX模型是通过将人类永生化细胞系移植到免疫功能低下的小鼠体内而建立的
细胞系来源的异种移植(CDX)模型被广泛使用体内抗癌治疗模型,并经常受雇于 初步药物筛选和抗癌药物评价。在 CDX 模型中,人类癌细胞系被注射到免疫缺陷小鼠体内。这些细胞可以皮下、静脉内或原位植入,以在各种微环境中诱导肿瘤。由于细胞系源自人类,因此必须将它们移植到免疫功能低下的小鼠模型中以防止排斥。一些常见的免疫受损小鼠模型包括 BALB/c 裸鼠、NOD/SCID 和 NCG (三重免疫缺陷小鼠模型)。
与同源小鼠细胞系类似,可以对人类癌细胞系进行广泛的表征。这允许选择合适的细胞系来建立相关的癌症模型。这些细胞系通常经过验证,可以更顺利地过渡到 体内初步学习后 细胞/组织 筛选。然而,值得注意的是,CDX 模型虽然对于评估新型抗癌化合物相对简单,但由于细胞系固有的遗传同质性,并不能完全复制在人类癌症中观察到的肿瘤内和肿瘤间异质性。
患者来源的异种移植 (PDX) 模型
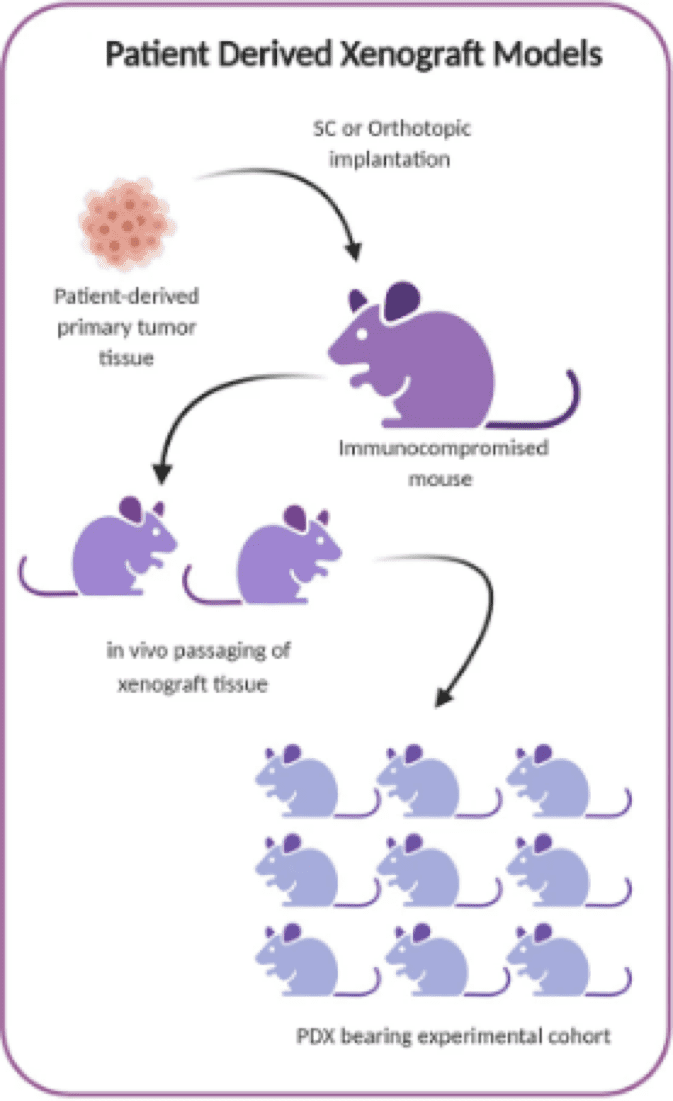
PDX模型是通过将整个患者来源的肿瘤组织移植到免疫功能低下的小鼠体内来建立的
患者来源的异种移植(PDX)模型是最具转化性的癌症药物开发临床前模型。在该模型中,来自患者的原发性肿瘤被直接植入免疫缺陷小鼠体内,而无需事先在细胞培养物中增殖。PDX模型紧密结合 模仿人类疾病 因为植入的肿瘤组织保留了患者体内发现的遗传和表观遗传异常,避免了体外适应的损害。此外,它们更好地反映了在人类患者群体中观察到的异质性和多样性。
为了建立 PDX 模型,将原发性肿瘤切成碎片并通过皮下或原位移植到免疫功能低下的小鼠体内。一旦肿瘤达到 1-2 立方厘米的大小,它们就会被切除,切成更小的尺寸,然后重新植入以扩大肿瘤碎片。第一代PDX称为F1,后续各代称为F2和F3。通常,肿瘤平均需要 2-4 个月的时间才能生长。来自不同世代的原始肿瘤组织和活检样本通常保存在冰箱中,用于随后的遗传和蛋白质组学评估。一般来说,PDX模型是使用低传代患者来源的肿瘤组织建立的,以保留原始肿瘤特征,包括人类基质成分。然而,这也意味着每个模型代表有限的资源。
由于 PDX 模型缺乏完整的免疫系统,因此它们的使用主要限于化疗药物,因为免疫治疗药物需要完整的免疫系统。为了解决这个限制,人源化免疫系统小鼠模型 被开发出来。这些模型涉及将人类免疫细胞(例如 CD34+ 造血干细胞或 PBMC)重建为 PDX 模型。为了产生这些小鼠,首先对免疫功能低下的小鼠进行照射以提高植入率。随后,将 CD34+ HSC 静脉注射到这些小鼠体内,然后将 PDX 肿瘤植入已成功植入人类免疫系统的小鼠体内。
为了确保高植入率,严重免疫功能低下的小鼠,例如 NCG (三重免疫缺陷小鼠模型)是首选。这些小鼠在 NOD 背景上敲除 Prkdc 和 Il2rg 基因,使它们成为移植人类肿瘤的优秀宿主。免疫受损小鼠的其他变体,例如支持骨髓细胞重建的 NCG-SGM3 和用于重建功能性 T 和 NK 细胞的 NCG-hIL15,是重建免疫细胞的宝贵工具。
这些小鼠模型都有其优点和局限性,模型的选择取决于具体的研究目标和要解决的问题。他们确实产生了大量信息,增进了我们对癌症生物学和药物开发的理解。此外,将多种模型与其他实验方法结合使用有助于确保在开发有效的癌症疗法时获得更可靠的转化结果。
-END-
素材源于网络,内容有改动
版权归原作者所有,侵删!
【北京细胞中心-iPSC细胞实验室】
— 感谢 · 阅读 —
北京北京细胞中心生物科技有限公司,是一所集临床、科研、国际学术交流为一体的全球生命科学研究公司,技术源头为美国圣地亚哥Biocentrium公司,公司致力于再生医学新技术的基础研究与临床应用转化,并将iPSc诱导多能干细胞培养技术平移到国内,同时与国内多家三甲医院开展科研课题。
现涵盖iPSc诱导多能干细胞,鲜活细胞、间充质干细胞、神经干细胞、血管内皮干细胞、软骨干细胞、NK/NKT/CTL/CAR-T/CAR-NK/DC-CIK/INKT等免疫细胞,肿瘤疫苗等;应用范围包括:疾病预防、两性生殖、神经系统疾病、脑部疾病、亚健康、免疫系统疾病、骨关节疾病等,同时拥有个体化iPS制备和分化成精原细胞、卵原细胞并形成精子、卵子技术、NSC脑部立体定向技术、NSC球后视神经靶向技术等。

