干细胞冶疗卵巢早衰最新研究进展
卵巢早衰(Premature Ovarian Failure, POF)或原发性卵巢功能不全(Primary Ovarian Insufficiency, POI)是指女性在40岁之前出现卵巢功能衰退,表现为闭经、雌激素水平降低和不孕等症状。传统治疗方法如激素替代疗法(HRT)虽能缓解症状,但无法从根本上恢复卵巢功能。近年来,干细胞疗法因其再生和修复潜力成为研究热点,为卵巢早衰的治疗提供了新方向。
1. 干细胞治疗卵巢早衰的机制
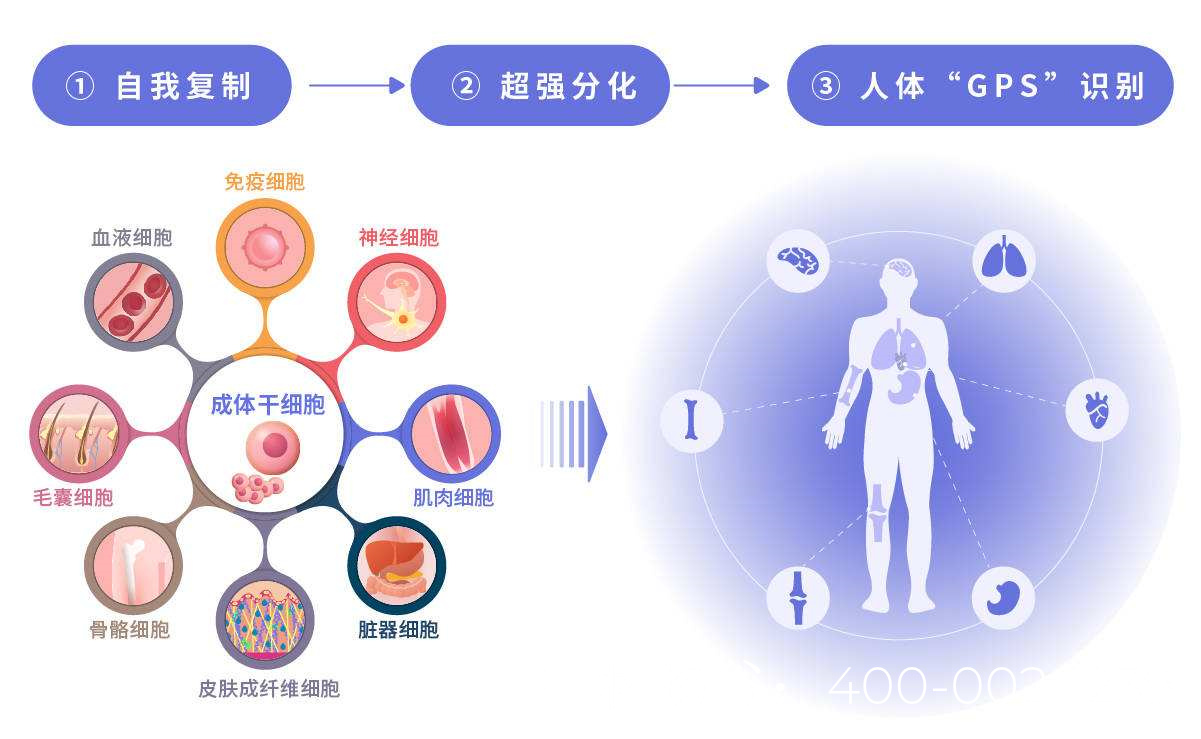
干细胞具有自我更新和多向分化潜能,可通过以下机制改善卵巢功能:
分化替代:干细胞可分化为卵泡细胞或颗粒细胞,补充受损的卵巢组织。
旁分泌作用:干细胞分泌生长因子(如VEGF、IGF-1、HGF等)促进血管生成、抑制细胞凋亡,并激活内源性修复机制。
免疫调节:通过调节Th1/Th2细胞平衡,减轻卵巢局部炎症反应,改善微环境。
2. 主要干细胞类型及研究进展
(1)间充质干细胞(MSCs)
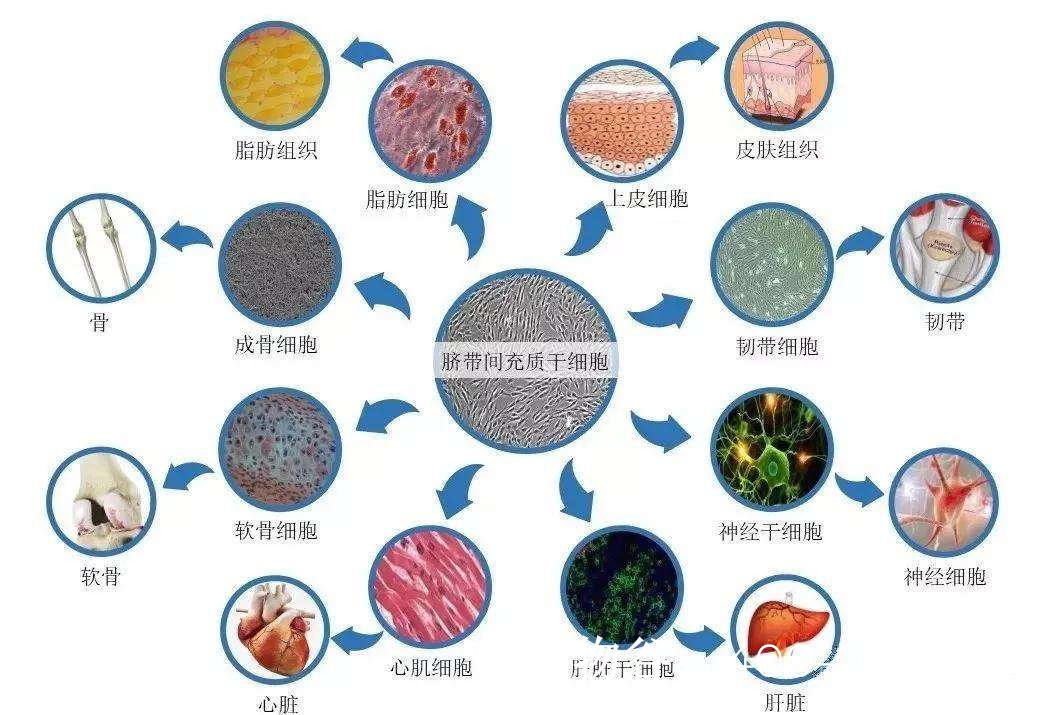
MSCs(来源于骨髓、脐带、脂肪等)是目前研究最广泛的干细胞类型:
骨髓间充质干细胞(BMSCs):动物实验显示,BMSCs移植可提高卵巢储备功能,促进卵泡发育。2023年一项临床研究(NCT03877471)报道,POF患者接受自体BMSCs移植后,部分患者恢复月经,AMH水平提升。
脐带间充质干细胞(UC-MSCs):UC-MSCs因其易获取、低免疫原性备受关注。中国学者发现,UC-MSCs通过激活PI3K/Akt信号通路改善卵巢功能(Li et al., 2022)。
脂肪间充质干细胞(ADSCs):ADSCs可通过外泌体递送miRNA(如miR-21-5p)抑制颗粒细胞凋亡(Sun et al., 2023)。
(2)诱导多能干细胞(iPSCs)
iPSCs可通过重编程体细胞获得,并分化为**样细胞。日本团队在《Science》发表研究,成功将iPSCs分化为功能性卵泡,为POF患者提供个性化治疗可能(Hayashi et al., 2021)。
(3)胚胎干细胞(ESCs)
ESCs具有全能性,但伦理限制和免疫排斥问题阻碍其临床应用。目前研究多集中于类器官培养,如利用ESCs构建卵巢类器官以模拟卵泡发育(Zhou et al., 2023)。
3. 临床研究现状
截至2024年,全球已有数十项干细胞治疗POF的临床试验注册(ClinicalTrials.gov):
中国:南京鼓楼医院团队报道,UC-MSCs联合胶原支架移植使30%的POF患者恢复排卵(2023)。
美国:一项I期试验(NCT03762913)评估BMSCs的安全性,初步结果显示无严重不良反应。
韩国:研究者采用ADSCs外泌体注射,显著改善患者激素水平(Kim et al., 2024)。
4. 结论
干细胞疗法为卵巢早衰的治疗带来了突破性希望,尤其是MSCs和外泌体的应用已显示出初步疗效。随着技术的进步和临床试验的推进,这一领域有望在未来5-10年内成为POF的常规治疗选择。