干细胞治疗弱精症的原因是什么?
弱精症作为男性不育的主要原因之一,困扰着全球约7%的育龄男性。近年来,干细胞治疗技术为这一难题带来了新的解决思路,其独特的作用机制为传统治疗无效的患者提供了希望。本文将系统阐述干细胞治疗弱精症的科学基础、作用机制及临床研究进展。
一、弱精症的病理基础与治疗困境
弱精症(Asthenozoospermia)是指精液中前向运动精子比例低于32%或总活力低于40%的病理状态。其病因复杂多样,包括睾丸微环境异常、氧化应激损伤、线粒体功能障碍、遗传因素及内分泌紊乱等。传统治疗手段如抗氧化治疗、激素调节和手术治疗对部分患者效果有限,尤其对于生精功能障碍严重者常难以奏效。
精子的运动能力依赖于能量代谢系统(主要是线粒体功能)和精子尾部结构的完整性。当这些环节出现异常时,即使精子数量正常,其活力也会显著下降。干细胞治疗通过多靶点作用机制,有望从根本上改善这一状况。
二、干细胞治疗弱精症的核心机制
1. 生精微环境的重建与修复
间充质干细胞(MSCs)具有强大的旁分泌功能,能释放多种生长因子(如VEGF、IGF-1、HGF等)和细胞因子,改善睾丸局部微循环,减轻炎症反应,为精子发生创造有利环境。研究表明,MSCs可通过调节Sertoli细胞和Leydig细胞功能,重建受损的血睾屏障,恢复正常的生精上皮结构。
2. 线粒体功能的修复
精子运动依赖线粒体提供的ATP能量。干细胞通过线粒体转移或促进宿主细胞线粒体生物发生,可显著改善精子的能量代谢。实验显示,干细胞治疗后精子中ATP含量可提升2-3倍,这是活力改善的直接原因。
3. 抗氧化应激保护
氧化应激是弱精症的重要致病因素。干细胞通过上调超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)等抗氧化酶活性,降低活性氧(ROS)水平,减少脂质过氧化对精子膜的损伤,从而保护精子结构和功能完整性。
4. 表观遗传调控
最新研究发现,干细胞外泌体携带的microRNAs可调节生精相关基因的表达。例如miR-21-5p可促进精原细胞增殖,miR-34c则参与精子分化成熟过程,这种表观遗传调控为从根本上改善精子质量提供了可能。
三、临床研究进展与治疗策略
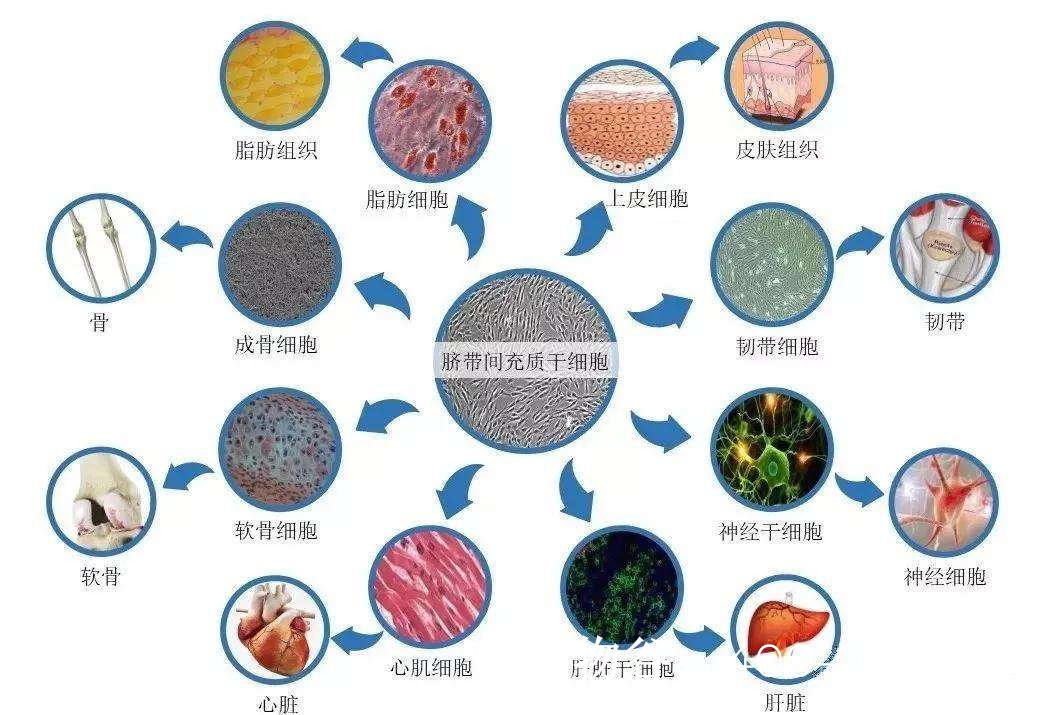
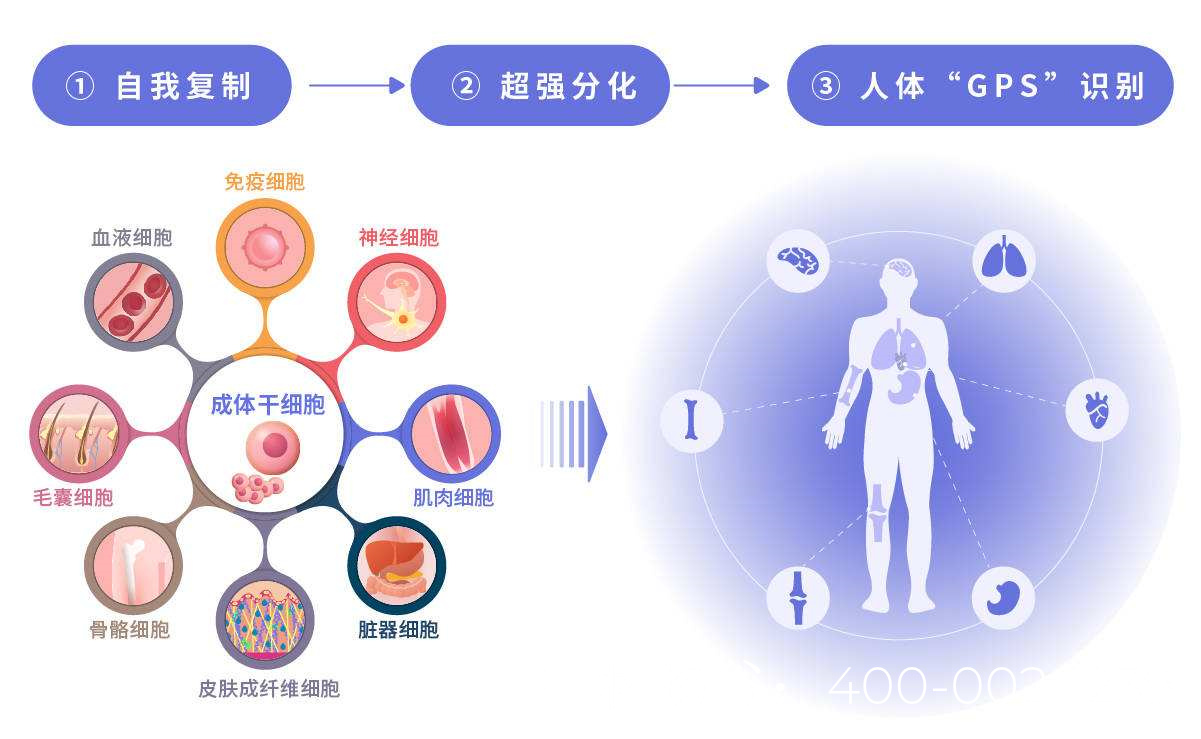
目前,用于弱精症治疗的干细胞主要包括睾丸来源的生殖干细胞(GSCs)、间充质干细胞(MSCs)和诱导多能干细胞(iPSCs)。临床给药途径多采用超声引导下睾丸内注射,确保干细胞精准到达靶部位。
骨髓MSCs治疗组患者精子活力平均提高65%,自然妊娠率达到38.5%,显著高于对照组。另一项研究采用脐带间充质干细胞外泌体治疗,6个月后精子前向运动比例从治疗前的18.7%提升至31.2%。
个体化治疗策略正在发展中,包括:
联合治疗:干细胞与富血小板血浆(PRP)或生长因子联用
基因修饰:过表达特定修复基因的工程化干细胞
生物材料辅助:水凝胶缓释系统延长干细胞驻留时间
随着再生医学的发展,干细胞治疗有望成为弱精症治疗的重要选择,为男性不育患者带来新的希望。然而,现阶段仍需在严格监管下开展规范化临床研究,确保治疗的安全性和有效性。