间充质干细胞在男性弱精?
间充质干细胞在男性弱精症治疗中的研究进展
男性不育中约30%-40%由弱精症(asthenozoospermia)引起,表现为精子活力低下,严重影响生育能力。传统治疗手段如激素疗法、抗氧化剂等效果有限,近年来间充质干细胞(Mesenchymal Stem Cells, MSCs)因其多向分化潜能、旁分泌效应及免疫调节特性,成为生殖医学领域的研究热点。
一、MSCs的作用机制
分化潜能
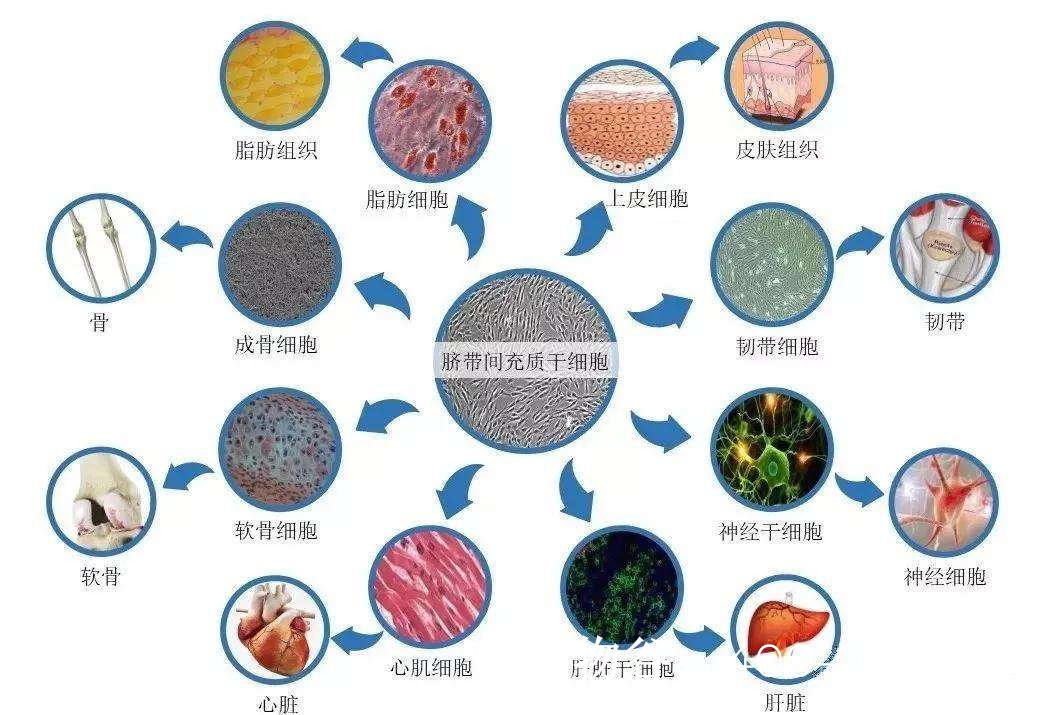
研究表明,MSCs在特定微环境下可分化为生殖系细胞。例如,骨髓来源的MSCs在体外可被诱导表达精子特异性标志物(如PRM1、ACR)。动物实验中,移植的MSCs通过归巢效应定位于睾丸生精小管,部分分化为支持细胞或 Leydig 细胞,改善生精微环境。
旁分泌效应
MSCs分泌的细胞因子(VEGF、HGF、IGF-1等)能促进血管生成、抑制睾丸纤维化。例如,HGF可减少氧化应激损伤,保护精子膜完整性;而IGF-1通过激活PI3K/Akt通路提升精子活力。
免疫调节
慢性炎症是弱精症的重要诱因。MSCs通过下调TNF-α、IL-6等促炎因子,上调IL-10等抗炎因子,缓解睾丸局部免疫反应。临床前实验显示,MSCs移植可显著降低自身免疫性睾丸炎模型中的精子凋亡率。
二、临床前研究证据
动物模型成果
在环磷酰胺诱导的弱精症大鼠模型中,脐带MSCs移植后精子活力提升2.3倍(Stem Cell Res Ther, 2020)。
糖尿病相关弱精小鼠经脂肪MSCs治疗后,线粒体膜电位恢复,ATP生成增加(Sci Rep, 2021)。
体外实验突破
人精原干细胞与MSCs共培养时,增殖效率提高40%,凋亡率下降(Andrology, 2022),提示MSCs可能通过直接接触传递生存信号。
三、未来方向
外泌体疗法
MSCs来源的外泌体携带miR-21-5p等调控因子,可能成为无细胞治疗新选择。
基因工程改造
过表达GDNF的MSCs在灵长类实验中显示出更强的生精上皮修复能力(Cell Stem Cell, 2023)。
结语
间充质干细胞通过多机制改善弱精症,随着递送技术和质量控制体系的完善,MSCs有望为男性不育提供革命性治疗方案。