男性不育无精症干细胞治疗方法
男性不育是影响全球约15%育龄夫妇的重要健康问题,其中无精症(azoospermia)占男性不育病例的10%-15%。无精症指精液中完全缺乏精子,可分为梗阻性无精症(OA)和非梗阻性无精症(NOA)。传统治疗方法如手术取精(如TESE、Micro-TESE)和辅助生殖技术(如ICSI)对部分患者有效,但对于NOA患者,尤其是生精功能障碍者,治疗选择有限。近年来,干细胞疗法为无精症的治疗提供了新的希望。
无精症的病因与分类
梗阻性无精症(OA):输精管道阻塞导致精子无法排出,但睾丸生精功能正常。
非梗阻性无精症(NOA):睾丸生精功能受损,可能由遗传因素(如克氏综合征、Y染色体微缺失)、内分泌异常(如低促性腺激素性性腺功能减退)、放化疗或环境因素引起。
对于NOA患者,传统治疗手段效果有限,而干细胞疗法可能通过修复受损的生精微环境或促进精子发生提供新的治疗途径。
干细胞治疗无精症的研究进展
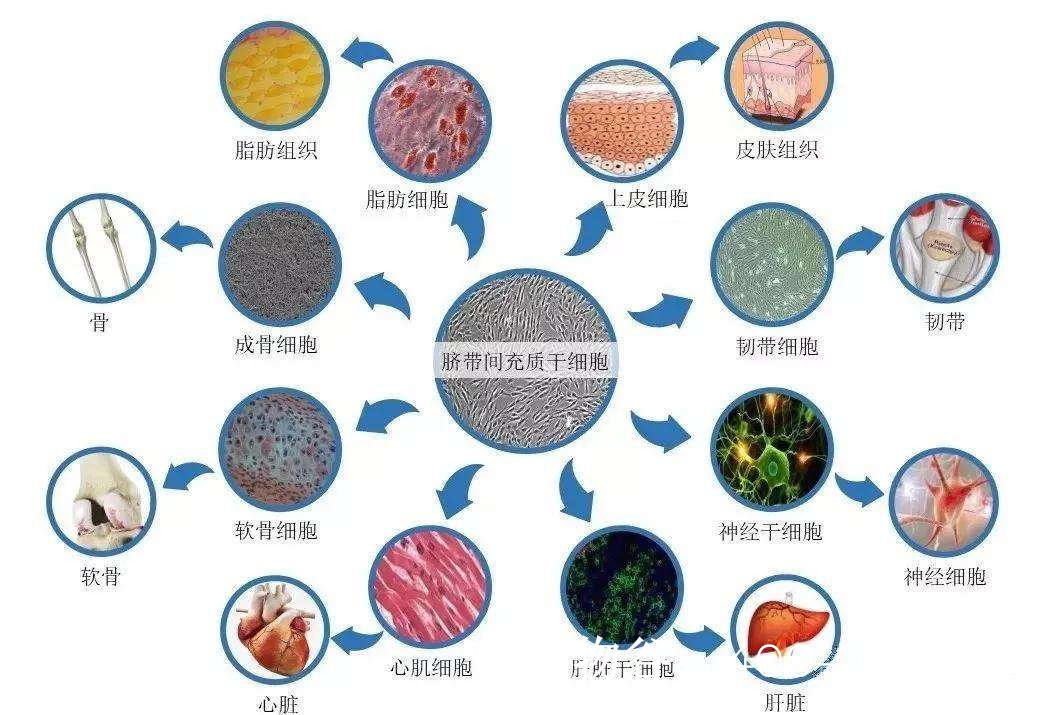
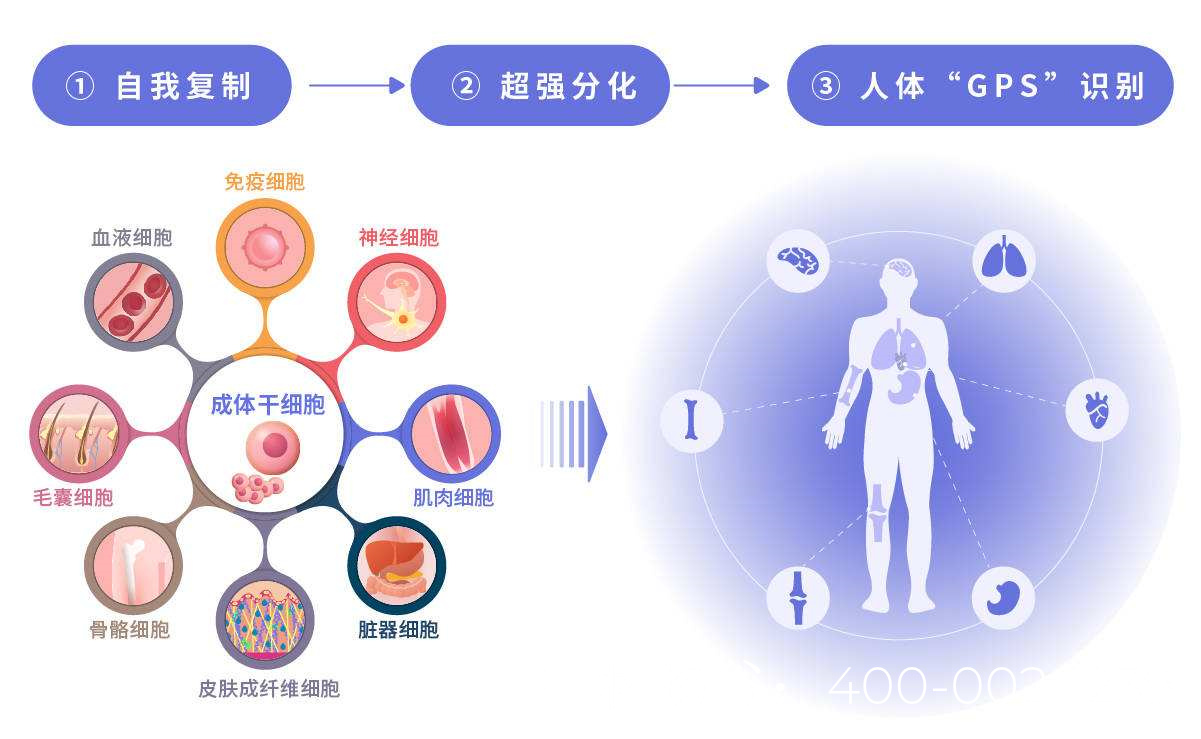
干细胞具有自我更新和分化为多种细胞类型的潜能,在男性不育治疗中主要探索以下几种干细胞类型:
1. 精原干细胞(SSCs)移植
精原干细胞是精子发生的基础,在睾丸内可分化为成熟精子。对于NOA患者,理论上可通过移植健康的SSCs恢复生精功能。
动物实验:在小鼠模型中,移植SSCs成功使不育小鼠恢复生精能力并产生健康后代。
临床挑战:人类SSCs的分离、体外扩增和移植技术尚不成熟,且NOA患者的睾丸微环境可能无法支持移植细胞的存活和分化。
2. 间充质干细胞(MSCs)治疗
MSCs具有抗炎、促血管生成和修复组织损伤的作用,可能通过改善睾丸微环境促进精子发生。
研究进展:
动物实验显示,MSCs移植可恢复化疗或辐射损伤的睾丸功能。
一项临床研究报道,NOA患者接受骨髓MSCs移植后,部分患者精液中检测到少量精子。
机制:MSCs可能通过分泌生长因子(如GDNF、VEGF)支持生精细胞存活和增殖。
3. 诱导多能干细胞(iPSCs)技术
iPSCs可通过体细胞重编程获得,并分化为精原干细胞或精子前体细胞。
研究进展:
小鼠实验中,iPSCs已成功分化为功能性精子并产生健康后代。
人类iPSCs分化为精子的研究仍在早期阶段,面临伦理和技术挑战。
结论
干细胞疗法为无精症,尤其是NOA患者提供了潜在的治疗选择。随着再生医学的发展,这一技术有望成为男性不育治疗的重要突破。未来需结合基因编辑、组织工程等先进技术,推动其向临床转化。