干细胞治疗无精症的最新进展
无精症(azoospermia)是男性不育的主要原因之一,指精液中完全无精子存在。传统治疗方法(如手术取精或激素治疗)效果有限,而干细胞治疗因其再生潜力成为研究热点。近年来,科学家在干细胞分化精子样细胞(SLCs)及修复受损睾丸微环境方面取得重要突破,为无精症患者带来新希望。
1. 干细胞治疗无精症的科学基础
无精症分为梗阻性(OA)和非梗阻性(NOA)两类,后者因生精功能障碍更难治疗。干细胞治疗的核心思路包括:
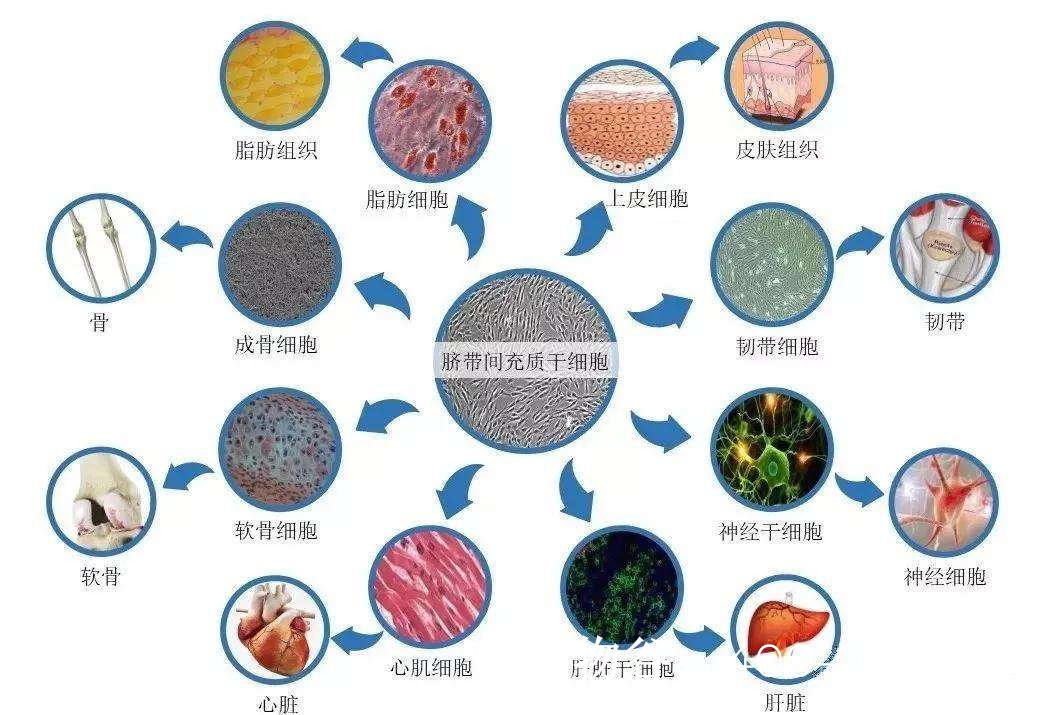
分化精子前体细胞:多能干细胞(如胚胎干细胞ESC、诱导多能干细胞iPSC)可分化为精原干细胞(SSCs),进而发育为成熟精子。
修复睾丸支持细胞:间充质干细胞(MSCs)可分泌营养因子,改善睾丸微环境,促进内源性精子发生。
2. 最新研究进展
(1)多能干细胞分化为功能性精子
2023年,日本京都大学团队在《科学》子刊发表研究,利用小鼠iPSC成功分化出SSCs,并移植至不育小鼠睾丸内,最终产生健康后代。同年,中国科学家通过3D睾丸类器官培养,使人源iPSC分化为减数分裂后的圆形精子细胞,但尚未完成全程成熟。
(2)间充质干细胞的旁分泌效应
多项临床试验(如NCT02025270)显示,脐带或骨髓来源的MSCs可通过分泌VEGF、IGF-1等因子,减少睾丸纤维化,恢复部分NOA患者的精子发生。2024年一项伊朗研究报道,MSCs联合激素治疗使15%的NOA患者精液中检出精子。
(3)基因编辑联合干细胞治疗
对于遗传性无精症(如AZFa缺失),CRISPR-Cas9可修复患者iPSC的基因缺陷,再分化为SSCs。美国康奈尔大学团队在体外模型中成功修复了Klinefelter综合征(47,XXY)患者的干细胞,为个体化治疗提供可能。
结论
干细胞治疗无精症已从基础研究迈向临床探索,尤其iPSC与MSCs的组合策略潜力巨大。未来5-10年,随着类器官技术和基因编辑的成熟,无精症患者或有望通过自体干细胞获得生物学后代。