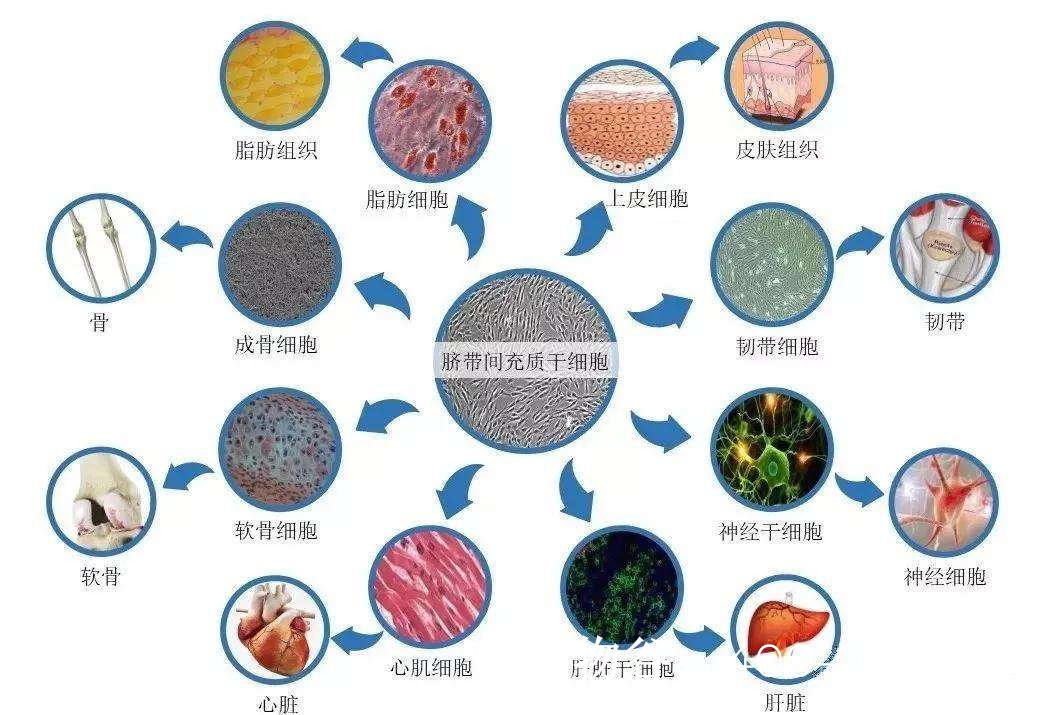
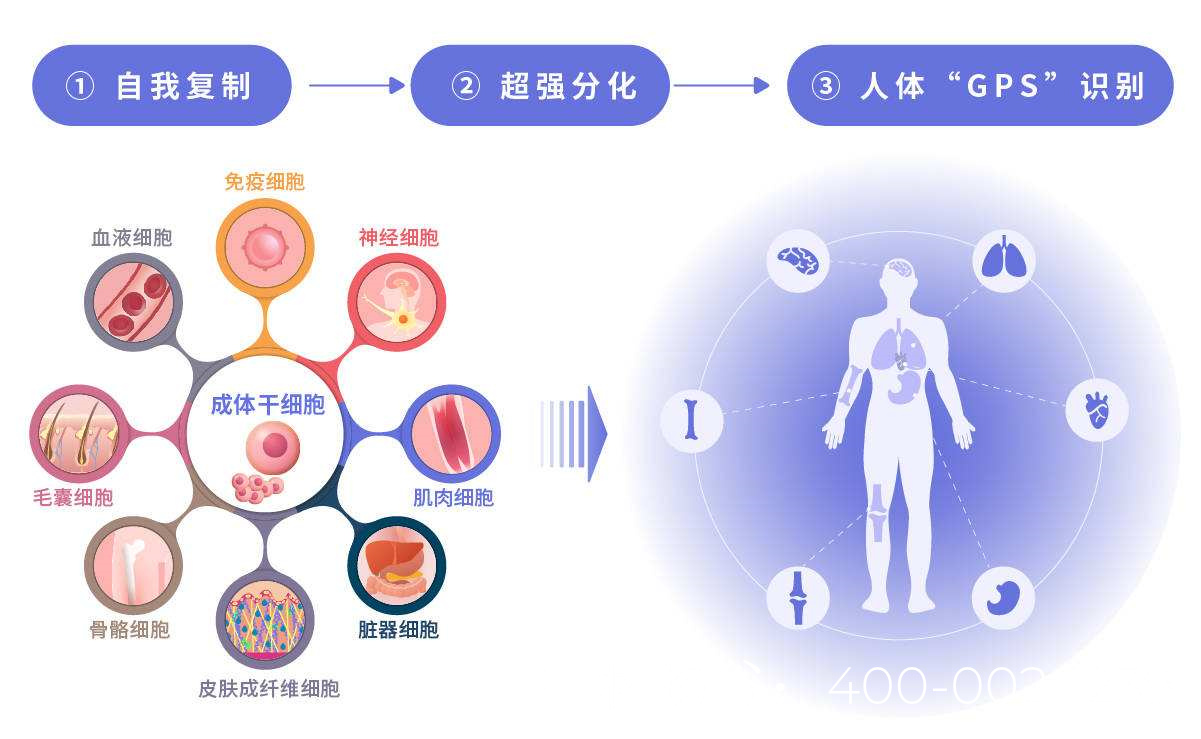
精原干细胞体外培养技术进展
精原干细胞(Spermatogonial Stem Cells, SSCs)是雄性哺乳动物精子发生的根基,具有自我更新和分化潜能。近年来,随着生殖生物学与再生医学的发展,SSCs体外培养技术取得了显著突破,为男性不育治疗、转基因动物培育及生殖毒性研究提供了新工具。本文综述了SSCs体外培养的关键技术进展、挑战及未来方向。
一、精原干细胞体外培养的意义
SSCs是睾丸中唯一能将遗传信息传递给后代的成体干细胞,其体外培养技术的成熟具有多重价值:
临床应用:为无精症患者提供自体精子再生方案;
生物保种:保存濒危动物或优质家畜的遗传资源;
基础研究:解析精子发生机制及生殖相关疾病病理。
二、关键技术突破
1. 培养体系优化
早期SSCs体外存活率低,主要受限于生长因子组合与基质选择。近年研究表明:
生长因子:GDNF(胶质细胞源性神经营养因子)、FGF2(碱性成纤维细胞生长因子)和EGF(表皮生长因子)是维持SSCs自我更新的核心因子,添加BMP4可促进其增殖;
基质材料:层粘连蛋白(Laminin)或明胶包被的培养皿更利于细胞贴附,三维培养体系(如软琼脂或微载体)可模拟体内微环境。
2. 共培养系统的应用
SSCs的存活依赖睾丸体细胞(如支持细胞)的旁分泌作用。研究者通过以下策略模拟这一互作:
与支持细胞共培养:小鼠模型中,SSCs与睾丸支持细胞共培养可长期维持干细胞特性;
条件培养基:使用支持细胞的条件培养基替代直接共培养,简化操作流程。
3. 无血清培养技术的进展
为避免血清批次差异带来的不确定性,无血清培养基(如StemPro-34)结合特定细胞因子(如LIF、IGF-1)已成功用于人和小鼠SSCs培养,显著提高实验可重复性。
4. 基因编辑与转分化研究
CRISPR-Cas9技术的应用使得SSCs成为基因编辑的理想靶点。此外,通过诱导SSCs转分化为多能干细胞(iPSCs)或**样细胞,拓展了其在再生医学中的潜力。
三、未来方向
类器官技术:构建睾丸类器官,模拟生精小管结构以支持SSCs分化;
单细胞组学:通过单细胞测序解析SSCs异质性,精准调控其命运;
材料工程:开发仿生支架材料优化微环境信号。
结语
精原干细胞体外培养技术的进步为生殖医学开辟了新路径,但其全面应用仍需跨学科合作攻克现有瓶颈。随着生物材料、微流控技术和人工智能的介入,SSCs研究有望在未来十年实现从实验室到临床的跨越。