干细胞治非梗阻无精症
非梗阻性无精症(Non-Obstructive Azoospermia, NOA)是男性不育的主要原因之一,其特征是睾丸生精功能障碍,导致精液中无精子。传统治疗方法(如激素疗法或显微取精术)效果有限,而干细胞治疗因其再生和分化潜能成为研究热点。本文将探讨干细胞在NOA治疗中的研究现状及未来前景。
非梗阻性无精症的病理机制
NOA的病因复杂,主要包括:
遗传因素(如克氏综合征、Y染色体微缺失);
内分泌异常(如FSH、LH分泌不足);
睾丸微环境损伤(如放疗、化疗或隐睾症);
生精细胞发育阻滞(精原干细胞无法分化为成熟精子)。
传统治疗手段难以修复受损的生精微环境,而干细胞技术可能通过再生医学途径提供新解决方案。
干细胞治疗的潜在机制
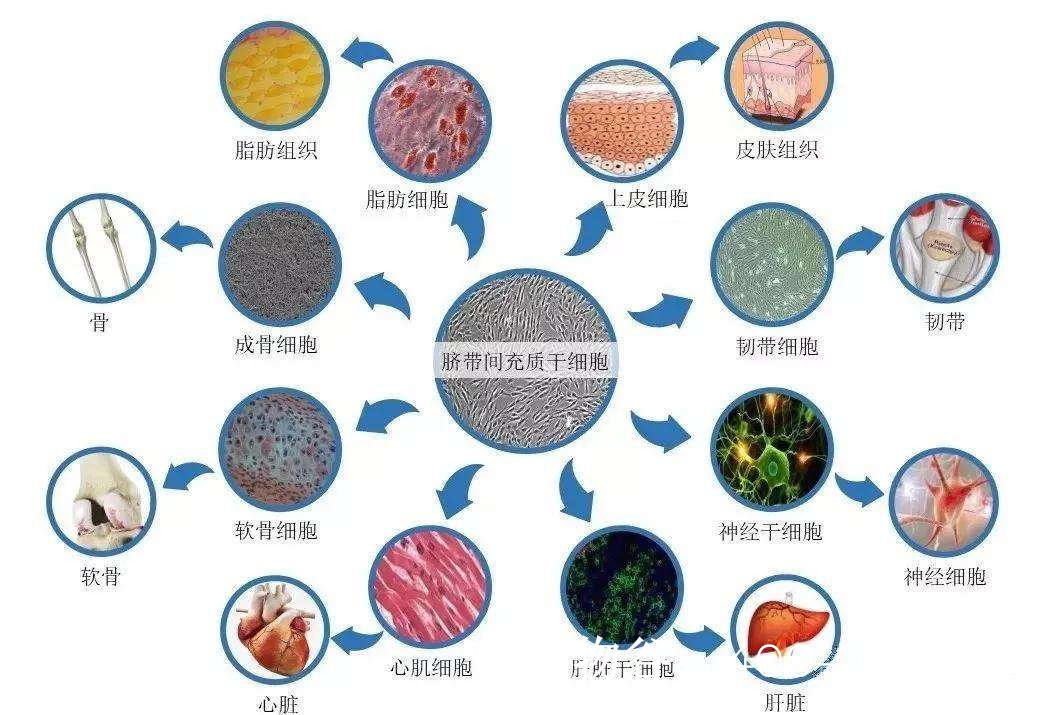
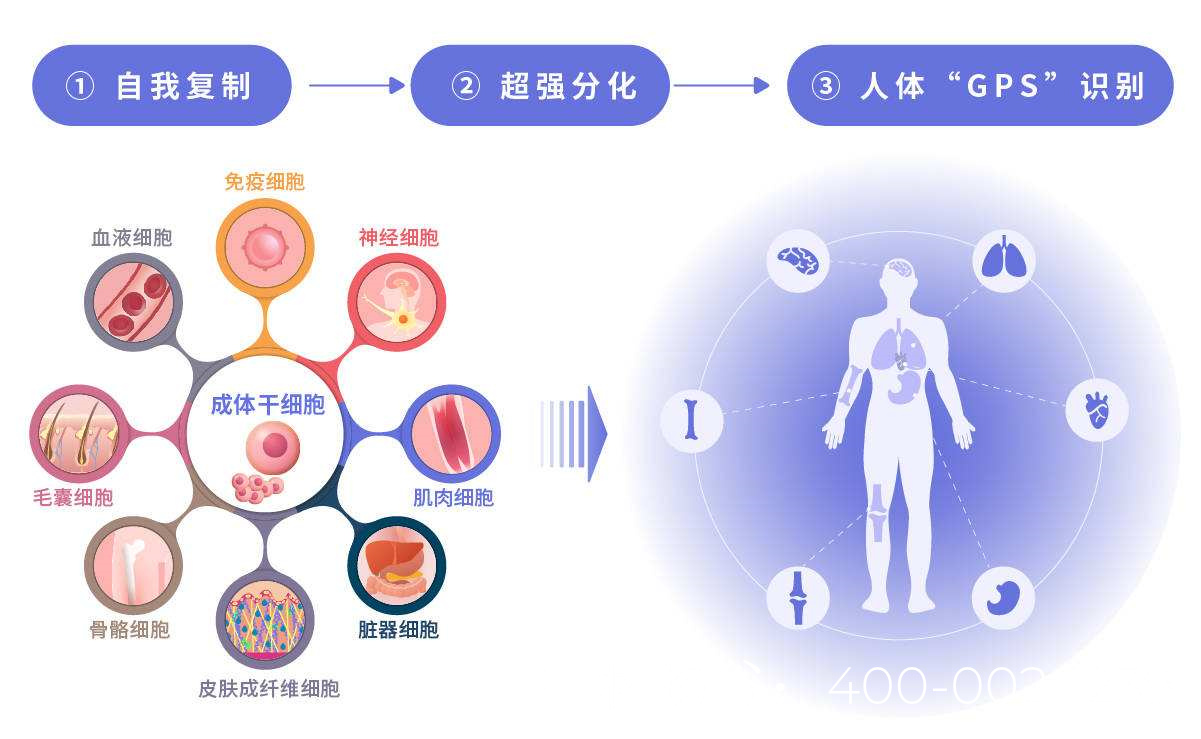
干细胞具有自我更新和多向分化能力,可能通过以下途径改善NOA:
分化为生精细胞:
胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)可在体外定向分化为精原干细胞(SSCs),并进一步形成精子。
动物实验中,移植的SSCs成功在小鼠睾丸内定居并产生精子。
改善睾丸微环境:
间充质干细胞(MSCs)通过分泌生长因子(如GDNF、FGF2)促进支持细胞功能,修复血睾屏障。
免疫调节:
MSCs可抑制睾丸局部炎症反应,减少纤维化,为精子发生创造有利条件。
未来展望
优化分化方案:通过3D类器官培养模拟睾丸微环境,提高精子发生效率。
联合治疗策略:结合激素疗法或基因编辑,增强干细胞治疗效果。
临床转化:需大规模随机对照试验验证长期安全性和生育结局。
结论
干细胞治疗为NOA患者提供了新的希望,但其临床应用仍面临技术、伦理和安全性挑战。未来研究需聚焦于提高干细胞定向分化效率、优化移植技术,并推动多学科协作,最终实现从实验室到临床的转化。