非梗阻性无精干细胞治疗
非梗阻性无精症(Non-Obstructive Azoospermia, NOA)是男性不育的主要原因之一,表现为睾丸生精功能障碍,导致精液中无精子。传统治疗方法如激素疗法或显微取精术(Micro-TESE)效果有限,而干细胞治疗因其潜在的再生能力成为研究热点。本文将探讨干细胞在NOA治疗中的研究进展、挑战及未来方向。
NOA的病理机制
NOA可分为先天性和获得性两类:
先天性因素:如克氏综合征(47,XXY)、Y染色体微缺失等基因异常。
获得性因素:包括放疗、化疗、睾丸炎或隐睾等导致的生精上皮损伤。
由于NOA患者的睾丸内可能残留少量精原干细胞(Spermatogonial Stem Cells, SSCs),但无法完成正常生精过程,因此干细胞治疗的核心目标是修复或替代受损的生精细胞。
干细胞治疗的潜在策略
1. 精原干细胞移植(SSCT)
SSCs是精子发生的基础,动物实验表明,将健康供体的SSCs移植到不育小鼠睾丸内可恢复生精功能。然而,人类SSCs的体外扩增和移植仍面临挑战:
免疫排斥风险:需使用患者自身的SSCs或匹配的供体细胞。
微环境支持不足:NOA患者的睾丸微环境可能无法支持移植的SSCs存活。
2. 多能干细胞(PSCs)分化为精子
诱导多能干细胞(iPSCs)或胚胎干细胞(ESCs)可分化为生殖细胞。近年研究显示:
体外精子发生:科学家已成功将小鼠ESCs诱导为功能性精子,并诞生健康后代。
类器官技术:利用睾丸类器官模拟生精微环境,促进干细胞分化。
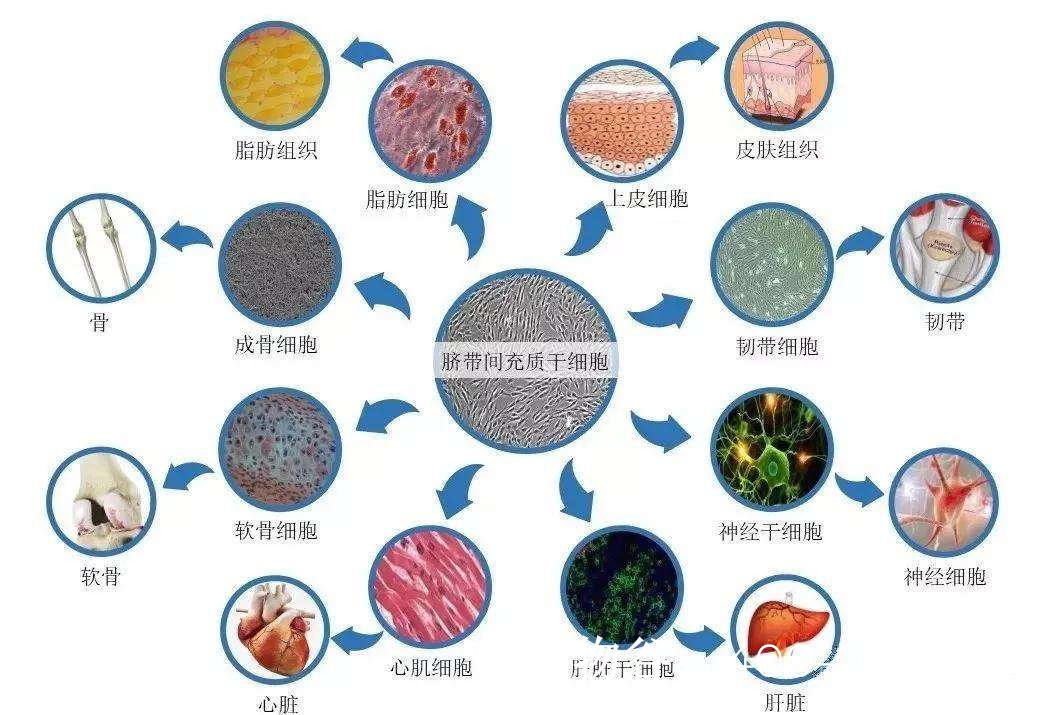
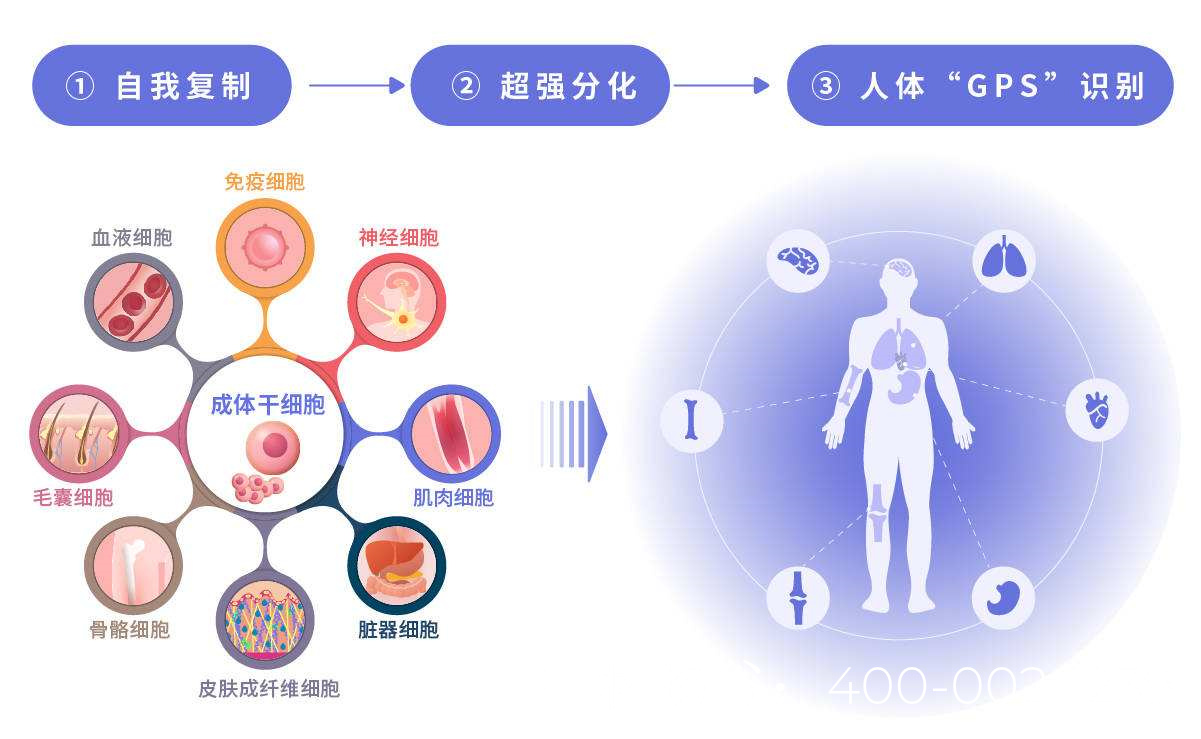
3. 间充质干细胞(MSCs)治疗
MSCs具有抗炎和修复组织的作用,可能通过以下机制改善NOA:
旁分泌效应:分泌生长因子(如GDNF、FGF2)促进内源性SSCs增殖。
免疫调节:减轻睾丸纤维化,改善微环境。
临床研究现状
动物模型成功案例:多项研究证实干细胞移植可恢复啮齿类动物的生精功能。
人类试验初步结果:少数临床研究报道MSCs注射可提高部分NOA患者的精子检出率,但样本量小,需进一步验证。
安全性问题:干细胞治疗的致瘤性和长期影响仍需评估。
结论
干细胞治疗为NOA患者提供了新的希望,尤其是结合基因编辑与组织工程技术,未来可能实现“定制化”生育方案。随着再生医学的发展,干细胞疗法有望成为NOA的突破性治疗手段。