睾丸性无精子症的干细胞治疗
睾丸性无精子症(Non-Obstructive Azoospermia, NOA)是男性不育的重要原因之一,其特征是睾丸生精功能障碍,导致精液中无精子。目前,传统的治疗方法如激素疗法或显微取精术(micro-TESE)效果有限,许多患者仍无法获得生物学子代。近年来,干细胞治疗为睾丸性无精子症提供了新的研究方向,尤其是通过干细胞移植或体外诱导分化为精子细胞的技术,展现出潜在的临床应用前景。
干细胞治疗的理论基础
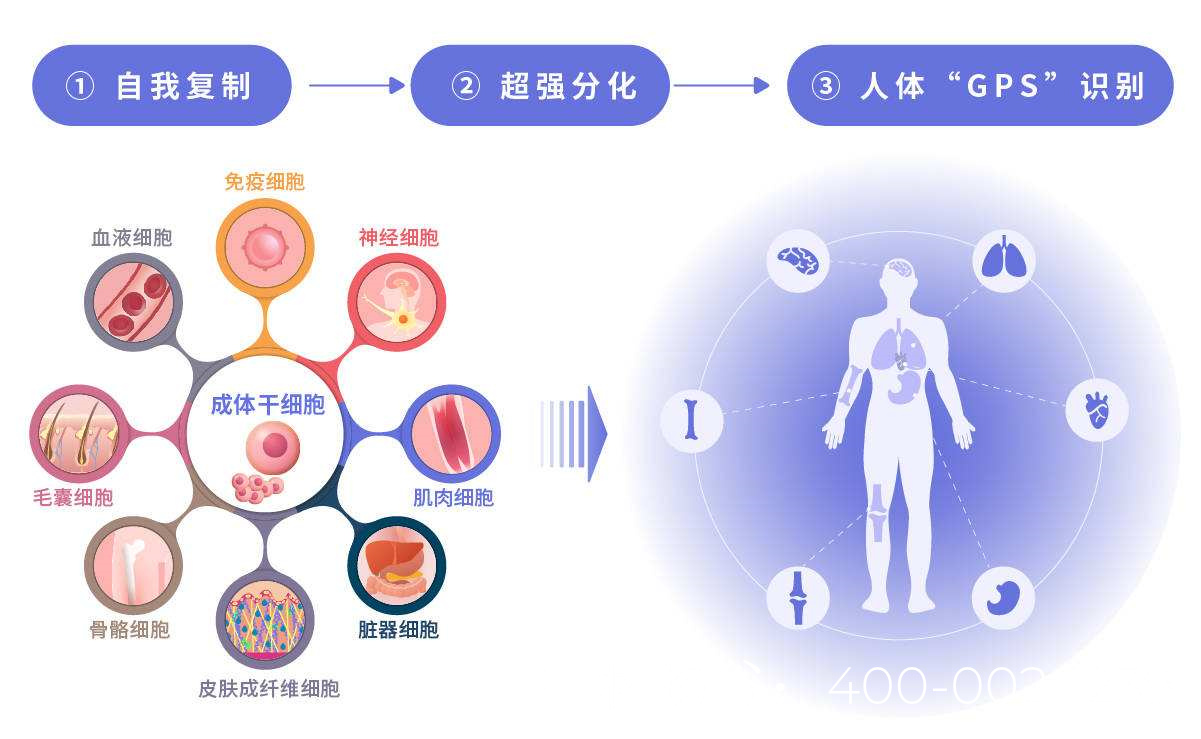
睾丸中的精子发生依赖于精原干细胞(Spermatogonial Stem Cells, SSCs)的自我更新和分化。在NOA患者中,SSCs的数量减少或功能异常导致生精障碍。干细胞治疗的核心思路包括:
精原干细胞移植(SSCT):将健康供体或患者自体经体外扩增的SSCs移植回睾丸,以恢复精子发生。
多能干细胞分化:利用胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)在体外定向分化为精子细胞,再移植或用于体外受精(IVF)。
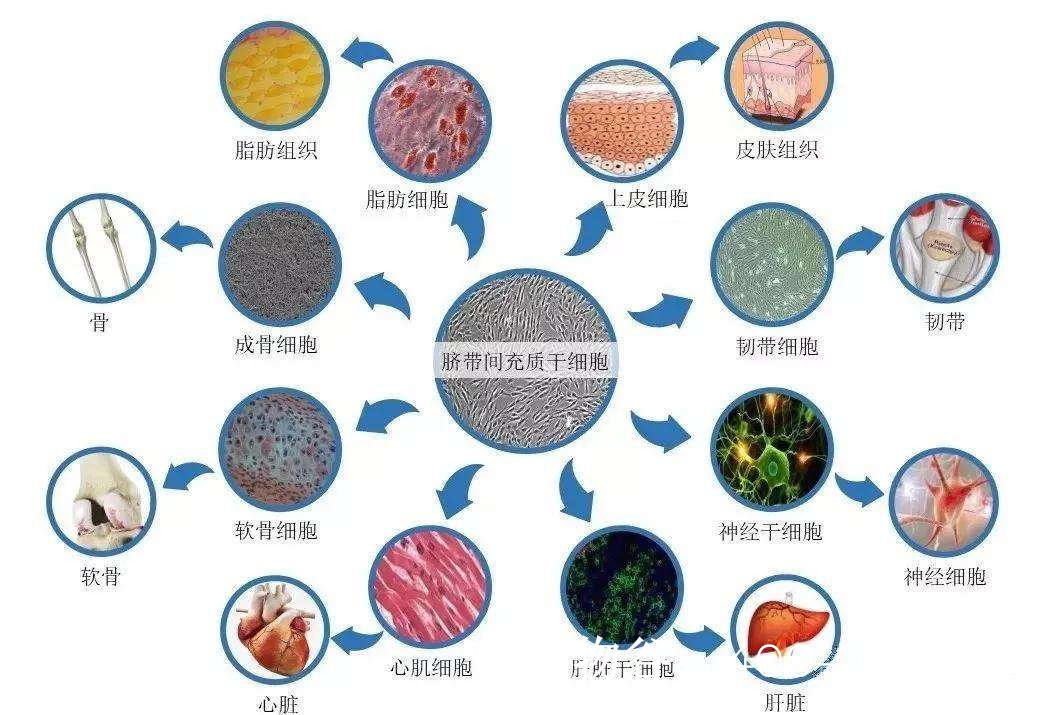
支持细胞与微环境修复:通过间充质干细胞(MSCs)改善睾丸微环境,促进SSCs存活和分化。
研究进展
1. 精原干细胞移植(SSCT)
动物实验已证实,将SSCs移植到不育小鼠睾丸内可恢复精子发生并产生健康后代。在人类研究中,科学家已成功从NOA患者睾丸中分离并体外扩增SSCs,但移植后的长期效果和安全性仍需进一步验证。
2. 多能干细胞分化为精子细胞
近年来,研究人员通过基因编辑和生长因子诱导,成功将ESCs和iPSCs分化为类精子细胞。例如,日本学者在体外将小鼠iPSCs分化为功能性精子,并成功繁育后代。人类研究虽尚未达到临床应用阶段,但已实现从多能干细胞诱导出减数分裂后的精子样细胞。
3. 间充质干细胞(MSCs)的辅助治疗
MSCs具有免疫调节和促血管生成作用,可改善睾丸纤维化和支持细胞功能。临床前研究表明,MSCs移植能部分恢复NOA模型的生精能力,但其机制尚不完全明确。
结论
干细胞治疗为睾丸性无精子症提供了革命性的治疗策略,但仍需更多基础研究和临床试验验证其安全性和有效性。随着再生医学的进步,这一领域有望为男性不育患者带来新的希望。