干细胞能治疗小睾丸无精症吗?
小睾丸无精症(也称为睾丸发育不良伴无精子症)是男性不育的重要原因之一,表现为睾丸体积小、生精功能障碍,精液中无法检测到精子。传统治疗方法(如激素疗法或手术取精)效果有限,而干细胞疗法因其再生和分化潜能,成为潜在的治疗选择。本文将探讨干细胞治疗小睾丸无精症的研究进展、挑战及未来方向。
干细胞治疗的潜在机制
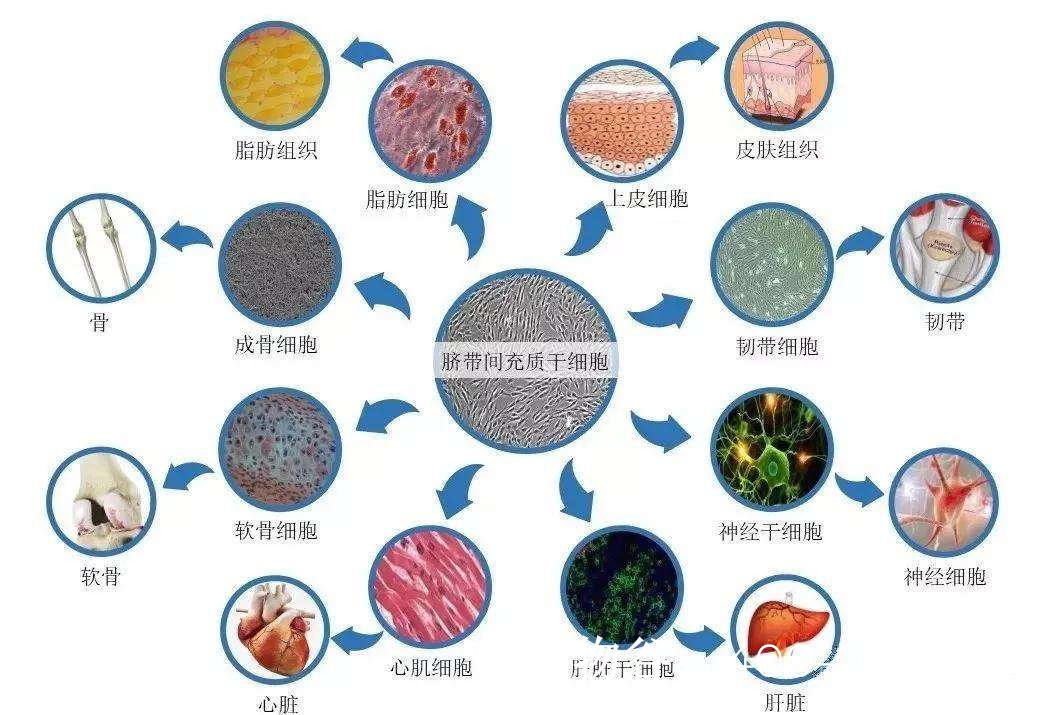
干细胞具有自我更新和分化为多种细胞类型的能力,理论上可以修复或替代受损的生精细胞。在小睾丸无精症中,可能的治疗机制包括:
分化为生精细胞:
胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)可在体外被诱导分化为精原干细胞(SSCs),并进一步发育为成熟精子。
动物实验已证明,移植SSCs可恢复无精症模型的精子发生。
促进睾丸微环境修复:
间充质干细胞(MSCs)可通过分泌生长因子(如GDNF、FGF2)改善睾丸支持细胞功能,促进生精微环境恢复。
基因编辑联合治疗:
对于遗传因素导致的无精症(如Y染色体微缺失),CRISPR-Cas9等基因编辑技术可结合干细胞疗法,修复缺陷基因。
研究进展
1. 动物实验
精原干细胞移植:在小鼠和大鼠模型中,移植健康供体的SSCs可使受体睾丸恢复精子生成,并成功繁育后代。
多能干细胞分化:科学家已成功将人类iPSCs分化为SSCs样细胞,但尚未实现功能性精子的体外生产。
2. 临床研究
间充质干细胞治疗:
2020年一项临床试验(NCT02025270)使用脐带MSCs治疗无精症患者,部分患者睾丸体积增大,但精子生成效果有限。
精原干细胞移植:
目前仅有个别案例报道,尚未大规模推广,主要受限于细胞来源和伦理问题。
未来展望
优化干细胞分化技术:
提高iPSCs向SSCs的分化效率,避免肿瘤风险。
基因治疗结合:
针对特定基因缺陷(如AZF区缺失),开发精准修复方案。
3D类器官培养:
利用睾丸类器官模拟生精微环境,提升干细胞存活率。
临床试验推进:
目前仍需更多I/II期试验验证安全性和有效性。
结论
干细胞治疗小睾丸无精症具有理论可行性,并在动物实验中取得一定进展,未来需结合基因编辑、组织工程等新技术,推动个体化治疗方案的发展。干细胞技术为无精症患者提供了新的希望。