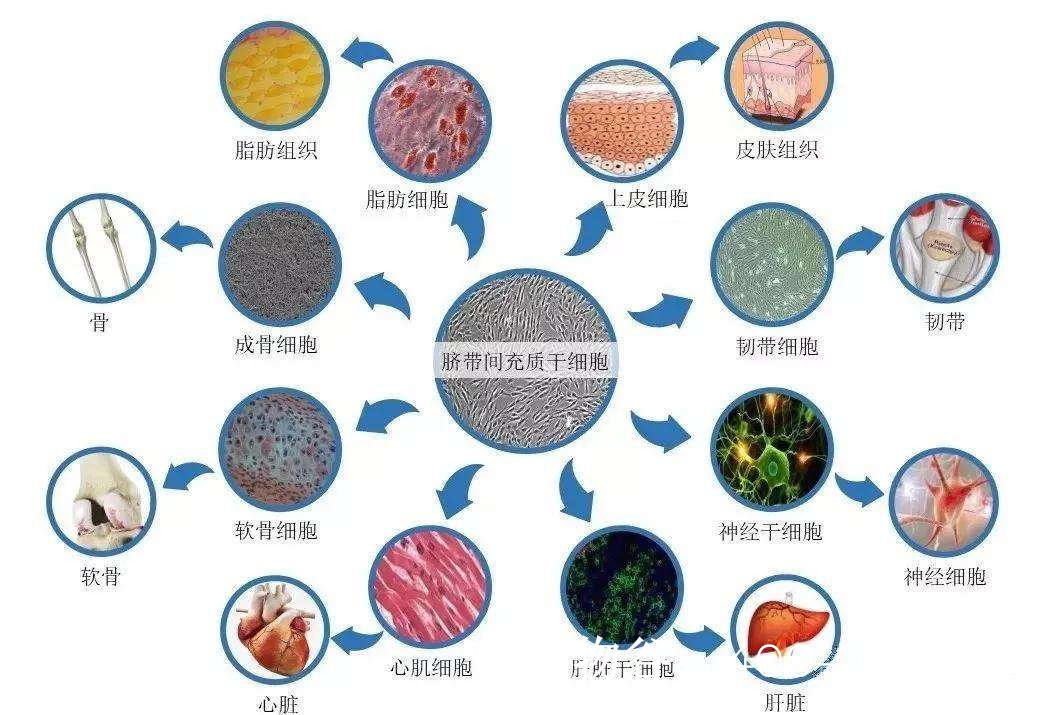
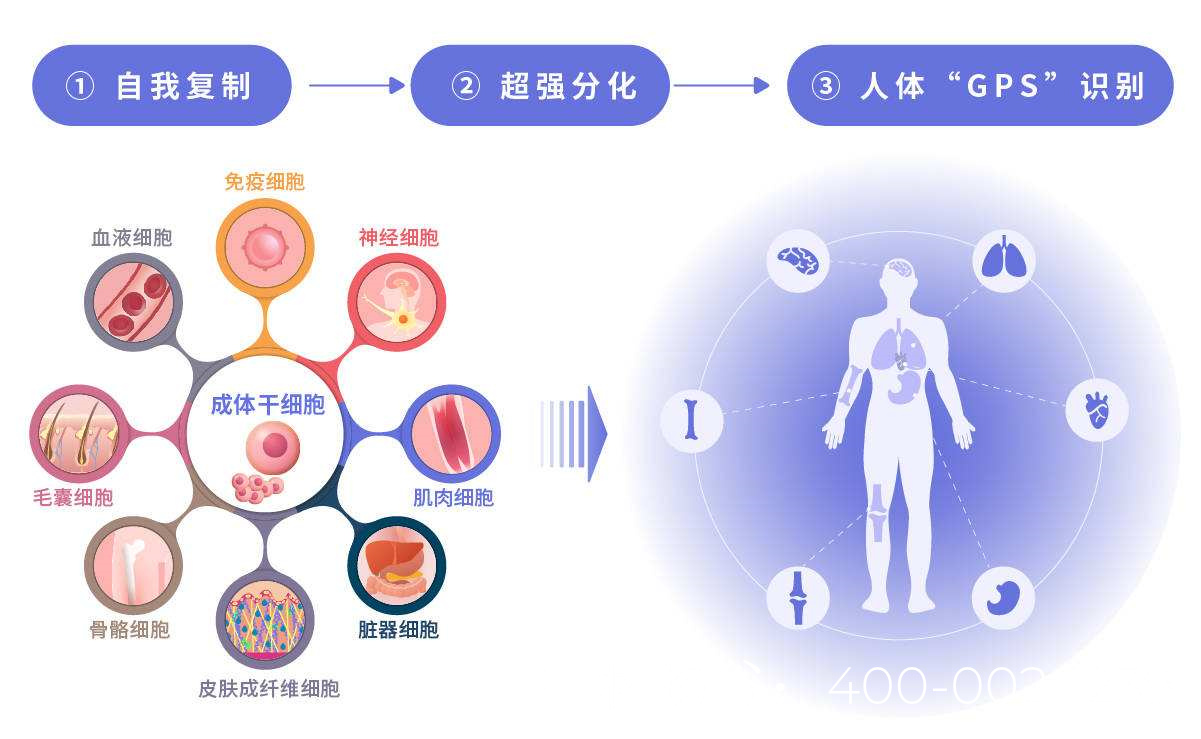
无精干细胞治疗的有效方法
无精子症是男性不育的主要原因之一,约占不育男性的10%-15%。传统治疗方法如药物、手术或辅助生殖技术(如ICSI)对部分患者有效,但对于非梗阻性无精子症(NOA)患者,由于睾丸内缺乏成熟精子,治疗效果有限。近年来,干细胞疗法为无精子症的治疗提供了新的希望,尤其是利用精原干细胞(SSCs)或诱导多能干细胞(iPSCs)进行再生医学治疗。本文将探讨无精干细胞治疗的有效方法及其研究进展。
1. 精原干细胞(SSCs)移植
精原干细胞是睾丸内具有自我更新和分化潜能的成体干细胞,能够分化为成熟精子。对于NOA患者,SSCs移植可能恢复精子发生过程。
1.1 干细胞来源
自体SSCs:从患者睾丸活检组织中分离培养SSCs,再回输至睾丸生精小管。
异体SSCs:若患者自身SSCs缺失,可考虑使用供体干细胞,但需克服免疫排斥问题。
1.2 关键技术
体外扩增:SSCs在体外培养条件下可大量增殖,提高移植成功率。
微环境优化:睾丸支持细胞(Sertoli细胞)和生长因子(如GDNF)可促进SSCs存活和分化。
1.3 临床挑战
免疫排斥:异体移植需配合免疫抑制剂或基因编辑技术(如CRISPR-Cas9)降低排斥反应。
移植效率:如何确保SSCs在睾丸内定植并启动精子发生仍需优化。
2. 诱导多能干细胞(iPSCs)分化为精子
iPSCs可通过体外重编程技术从体细胞(如皮肤细胞)获得,并分化为生殖细胞。
2.1 分化策略
体外精子发生:iPSCs在特定培养条件下可分化为原始生殖细胞(PGCs),再进一步诱导为精子样细胞。
类器官培养:利用睾丸类器官模拟体内微环境,促进精子成熟。
2.2 研究进展
动物实验:小鼠iPSCs已成功分化为功能性精子,并诞生健康后代。
人类研究:目前仍处于实验室阶段,尚未实现临床应用。
2.3 潜在问题
表观遗传异常:体外分化可能导致DNA甲基化错误,影响精子功能。
伦理争议:涉及人类配子的人工合成需严格监管。
3. 基因编辑与干细胞联合治疗
部分无精子症由基因突变(如AZFa/b/c缺失、DAZ基因缺陷)引起,结合CRISPR-Cas9等基因编辑技术可修复突变,提高干细胞治疗效果。
3.1 应用案例
基因修复:在iPSCs中纠正致病突变,再分化为健康精子前体细胞。
基因增强:引入促精子发生基因(如BOULE、DAZL)提高分化效率。
3.2 安全性考量
脱靶效应:需优化基因编辑精准度,避免非目标突变。
长期影响:修复后的干细胞是否稳定传递遗传信息仍需验证。
结论
无精干细胞治疗为男性不育提供了革命性解决方案,尤其是SSCs移植和iPSCs分化技术。尽管目前尚未广泛应用,但随着再生医学和基因编辑技术的发展,这一领域有望在未来10年内取得突破,为无精子症患者带来生育希望。