干细胞治疗患无精症的原因有哪些
干细胞治疗无精症的原因及其机制探讨
一、干细胞治疗无精症的科学基础
无精症作为男性不育中最严重的表现形式之一,传统治疗方法效果有限。近年来,干细胞治疗为这类患者带来了新的希望,其科学基础主要基于以下几点:
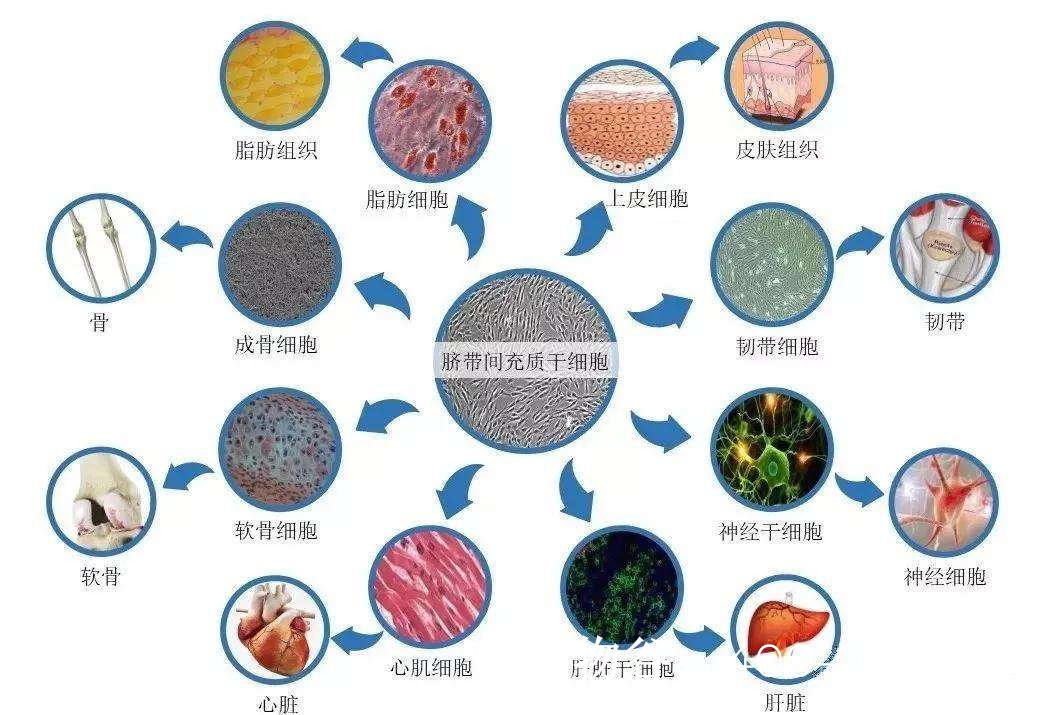
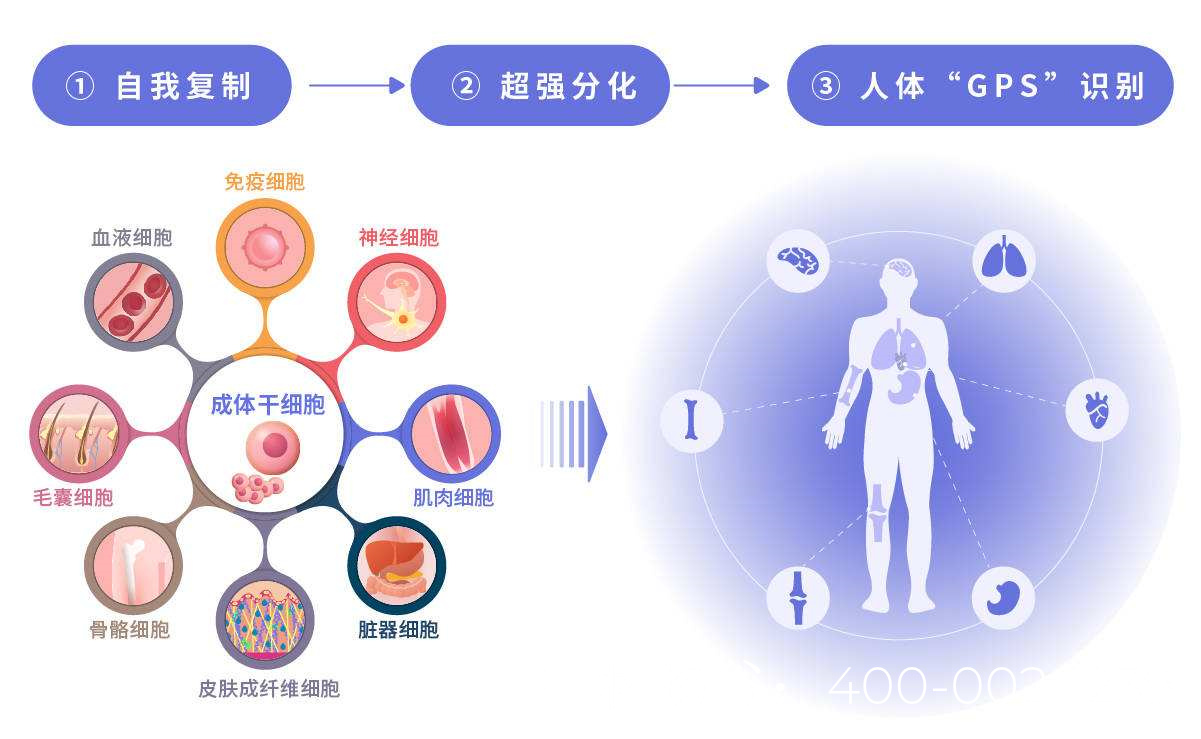
干细胞的自我更新与分化潜能:干细胞具有无限增殖和分化为多种细胞类型的能力,包括生殖细胞。研究表明,胚胎干细胞和诱导多能干细胞(iPSCs)在特定条件下可分化为原始生殖细胞样细胞(PGCLCs),这为重建精子发生过程提供了可能。
微环境重建能力:间充质干细胞(MSCs)可通过分泌多种细胞因子和生长因子,改善睾丸微环境,促进残留精原干细胞的增殖与分化。研究显示,MSCs分泌的GDNF、FGF2等因子对精原干细胞的维持至关重要。
免疫调节功能:干细胞特别是MSCs具有显著的免疫调节作用,可减轻睾丸局部炎症反应,这对免疫因素导致的无精症尤为重要。临床前研究证实,MSCs能通过调节T细胞亚群平衡,改善自身免疫性睾丸炎。
二、干细胞治疗不同类型无精症的作用机制
(一)非梗阻性无精症的治疗机制
非梗阻性无精症(NOA)占无精症病例的60%以上,主要由于生精功能障碍导致。干细胞治疗的作用机制包括:
替代受损的生殖干细胞:对于因化疗、放疗或遗传因素导致精原干细胞缺失的患者,移植的健康精原干细胞或体外诱导分化的生殖细胞可重新启动精子发生。动物实验证实,移植的精原干细胞能在受体睾丸内定植并产生正常精子。
内分泌调节:MSCs可通过旁分泌作用促进Leydig细胞功能,提高睾酮水平。一项临床研究显示,脐带MSCs移植后,60%的NOA患者血清睾酮水平显著提升。
血管再生:干细胞分泌的VEGF等促血管生成因子能改善睾丸缺血状态。研究表明,糖尿病性无精症模型动物经干细胞治疗后,睾丸血管密度增加40%,精子发生明显改善。
(二)梗阻性无精症的辅助治疗
虽然手术再通是梗阻性无精症的首选,但长期梗阻常导致生精上皮继发性损伤。干细胞的作用体现在:
抑制纤维化:MSCs通过下调TGF-β/Smad通路,减少胶原沉积,预防吻合术后的再梗阻。临床试验显示,联合干细胞治疗可使手术成功率提高25%。
促进上皮修复:干细胞分泌的HGF、EGF等因子能加速生精上皮的再生。显微注射MSCs到附睾头部,可显著改善精子成熟微环境。
三、干细胞来源的选择与治疗优势
不同来源干细胞在治疗无精症中各具特色:
精原干细胞(SSCs):自体移植可避免免疫排斥,但需患者睾丸内有残留SSCs。最新技术已能在体外扩增人类SSCs1000倍以上,为临床应用奠定基础。
间充质干细胞(MSCs):脐带、脂肪等来源的MSCs易于获取,伦理争议小。其旁分泌效应显著,特别适合微环境重建。韩国一项II期临床试验显示,脐带MSCs治疗使32%的NOA患者精液中检出精子。
诱导多能干细胞(iPSCs):适用于遗传性无精症,可通过基因编辑纠正突变后再分化。日本研究团队已成功将人类iPSCs分化为功能性精子,但安全性仍需验证。
与传统方法相比,干细胞治疗具有微创性、个体化和潜在根治性优势。特别是对于Y染色体微缺失等遗传因素导致的无精症,结合基因编辑的干细胞治疗可能是唯一根治手段。
四、现存挑战与未来展望
随着3D睾丸类器官、单细胞测序等技术的发展,精准调控精子发生过程将成为可能。未来5-10年,随着更多III期临床数据的积累,干细胞治疗有望成为无精症的标准疗法之一,为众多不育家庭带来福音。