非梗阻性无精症干细胞能治疗好吗?
非梗阻性无精症(Non-Obstructive Azoospermia, NOA)是男性不育中最棘手的问题之一,指睾丸生精功能衰竭导致精液中无精子存在的病症。近年来,干细胞疗法为这一难治性疾病带来了新的希望,但其实际疗效。
干细胞治疗的理论基础
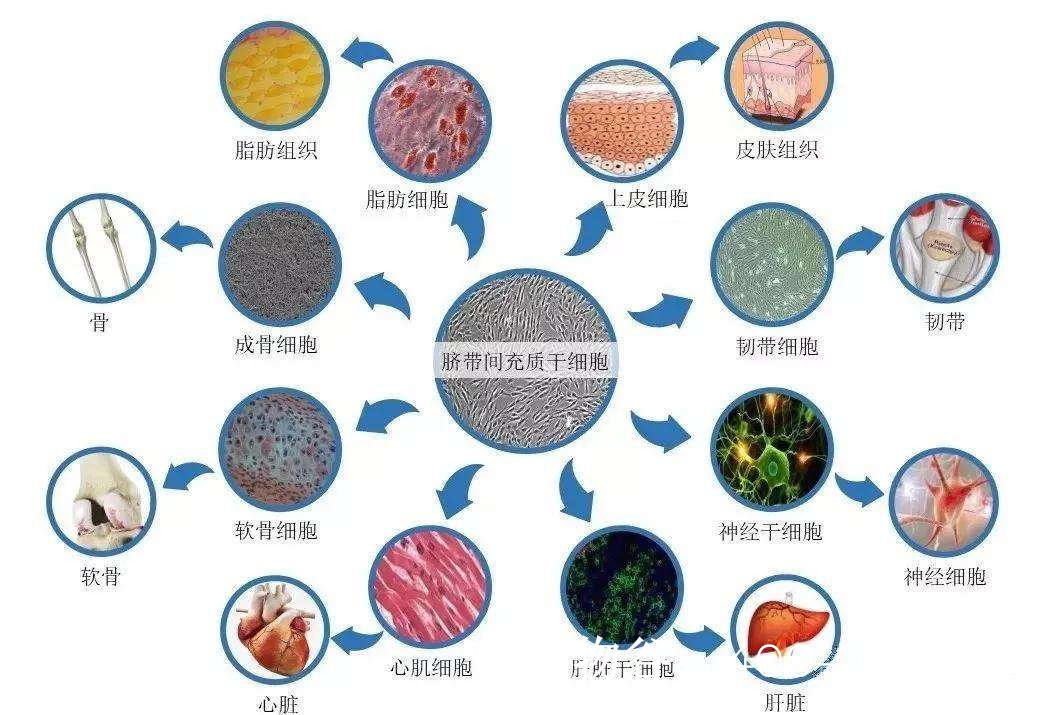
干细胞具有自我更新和分化为多种细胞类型的潜能,理论上可以解决NOA的核心问题——精原干细胞缺失或功能障碍。研究表明,多能干细胞(包括胚胎干细胞和诱导多能干细胞)在特定条件下可被诱导分化为原始生殖细胞样细胞,并进一步发育为精子细胞。2011年,日本科学家首次将小鼠胚胎干细胞转化为有功能的精子,使不育小鼠成功生育后代,这一突破为人类NOA治疗提供了概念验证。
当前研究进展
近年来,科学家们在多个方向取得进展:一是建立了从人类多能干细胞诱导产生原始生殖细胞样细胞的技术路线;二是在三维培养系统中模拟了睾丸微环境,支持生殖细胞发育;三是探索了使用患者自体细胞重编程为iPSC再分化为生殖细胞的个性化治疗方案。2020年,中国研究者报道了将人类胚胎干细胞诱导为精原干细胞样细胞的成果,这些细胞表现出与天然精原干细胞相似的分子特征。
临床应用面临的主要障碍
尽管前景广阔,干细胞治疗NOA仍存在重大技术瓶颈。安全性问题首当其冲,干细胞移植可能导致畸胎瘤形成,而体外诱导的生殖细胞是否具有完整遗传和表观遗传特征仍需验证。效率低下是另一挑战,目前分化方案产出的功能性生殖细胞比例不足1%。此外,伦理争议也不容忽视,特别是涉及胚胎干细胞使用时。从实验室研究到临床应用的转化还需要解决细胞纯化、移植方法和长期随访等系列问题。
未来发展方向
该领域正朝着三个方向努力:一是优化培养体系,使用小分子化合物和生长因子组合提高分化效率;二是开发生物材料构建人工睾丸支架,模拟天然生精小管结构;三是探索基因编辑技术修复导致NOA的遗传缺陷。
总体而言,干细胞治疗非梗阻性无精症仍处于基础研究向临床过渡的阶段。虽然理论上具有治愈潜力,但短期内尚不能作为常规治疗手段。患者应保持理性期待,在专业医师指导下选择现有疗法(如显微取精术)的同时,关注该领域的突破性进展。未来5-10年,随着关键技术难题的逐步攻克,干细胞疗法有望为部分NOA患者带来生育自己遗传学后代的机会。