非梗阻性无精症干细胞怎么治疗
非梗阻性无精症干细胞治疗的研究进展与展望
一、引言
非梗阻性无精症(NOA)占男性不育病例的10%-15%,其特征是睾丸生精小管内生精细胞缺失或发育停滞,导致精液中无精子。传统治疗手段如激素疗法或显微取精术效果有限,而干细胞技术为NOA患者提供了新的希望。近年来,干细胞疗法通过再生受损组织或分化为功能性生殖细胞,成为生殖医学的研究热点。
二、干细胞治疗NOA的潜在机制
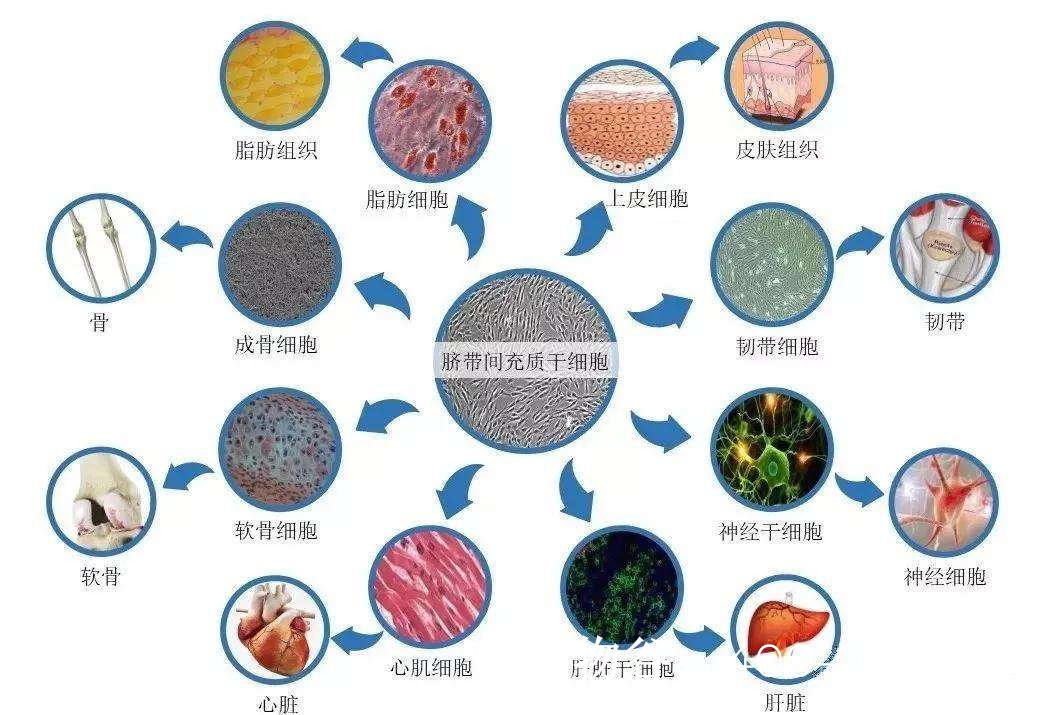
干细胞类型的选择
间充质干细胞(MSCs):骨髓、脐带或脂肪来源的MSCs可通过旁分泌作用抑制睾丸炎症反应,促进血管生成,改善微环境。例如,动物实验显示,移植的MSCs能上调睾丸内GDNF(胶质细胞源性神经营养因子)的表达,支持精原干细胞增殖。
精原干细胞(SSCs):自体或异体SSCs移植可尝试重建生精上皮。2014年日本团队成功将诱导多能干细胞(iPSCs)分化为SSCs样细胞,并在小鼠模型中产生精子。
多能干细胞(PSCs):胚胎干细胞(ESCs)或iPSCs可分化为生殖细胞谱系。2021年《科学》杂志报道,人类iPSCs在3D睾丸类器官中可形成前精原细胞。
关键作用途径
微环境修复:干细胞分泌的VEGF、HGF等因子可减轻睾丸纤维化,恢复支持细胞功能。
免疫调节:MSCs通过降低IL-6、TNF-α等炎性因子水平,缓解自身免疫对生精细胞的损伤。
直接分化:在特定诱导条件下(如添加视黄酸、BMP4等),干细胞可逐步分化为减数分裂后的圆形精子细胞。
三、临床转化现状与案例
注册临床试验
截至2023年,ClinicalTrials.gov登记了4项NOA干细胞疗法试验,包括土耳其的脐带MSCs注射(NCT05332266)和中国的SSCs扩增移植(NCT04827826),均处于Ⅰ/Ⅱ期阶段。
初步结果
伊朗Royan研究所2022年报告,5名NOA患者接受睾丸内MSCs注射后,2例在显微取精中发现少量精子,成功用于ICSI并诞生健康婴儿。
四、未来发展方向
技术优化
开发睾丸类器官共培养系统,模拟生精微环境。
单细胞测序技术助力精准追踪干细胞分化轨迹。
个体化治疗
基于患者基因突变(如DAZ、USP9Y缺失)设计定制化干细胞方案。
政策与产业化
需建立国际统一的生殖细胞治疗标准,推动GMP级干细胞库建设。
六、结语
随着类器官与基因编辑技术的进步,未来5-10年内或可实现临床突破,为无精症患者提供全新的生育解决方案。