非先天性无精症干细胞能治好吗?
无精症是男性不育的重要原因之一,约占男性不育病例的10%-15%。非先天性无精症(获得性无精症)指后天因素导致的精子生成障碍,与先天性因素导致的生精障碍不同。近年来,干细胞疗法为这类患者带来了新的希望。
非先天性无精症的病因与特点
非先天性无精症通常由感染(如腮腺炎性睾丸炎)、外伤、手术损伤(如腹股沟疝修补术)、放射治疗、化疗药物毒性、环境毒素暴露或内分泌紊乱等因素引起。与先天性无精症不同,这类患者通常具有正常的染色体核型和Y染色体微缺失检测结果,且其睾丸中可能仍存在少量精原干细胞,只是由于微环境破坏或血睾屏障受损导致精子发生过程受阻。
临床上,非先天性无精症患者表现为精液中完全无精子,但血清促卵泡激素(FSH)水平可能正常或轻度升高,睾丸体积接近正常或轻度缩小。这类患者通过睾丸精子抽取术(TESE)获得精子的成功率相对较高,约为40%-60%,为干细胞治疗提供了相对有利的基础条件。
干细胞治疗的潜在机制
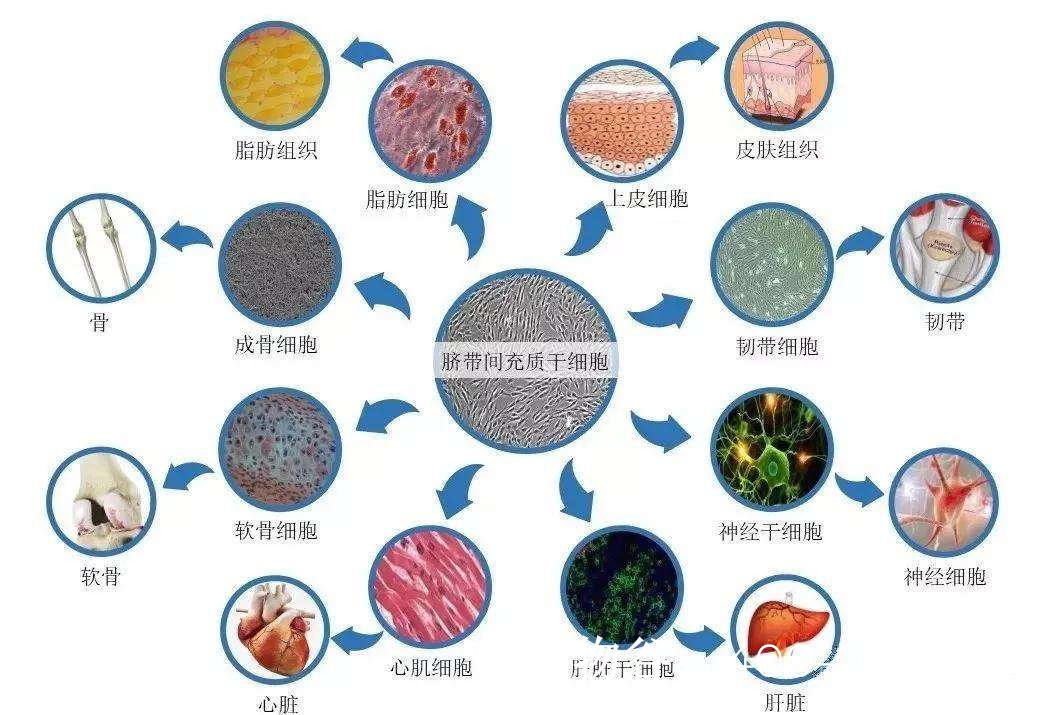
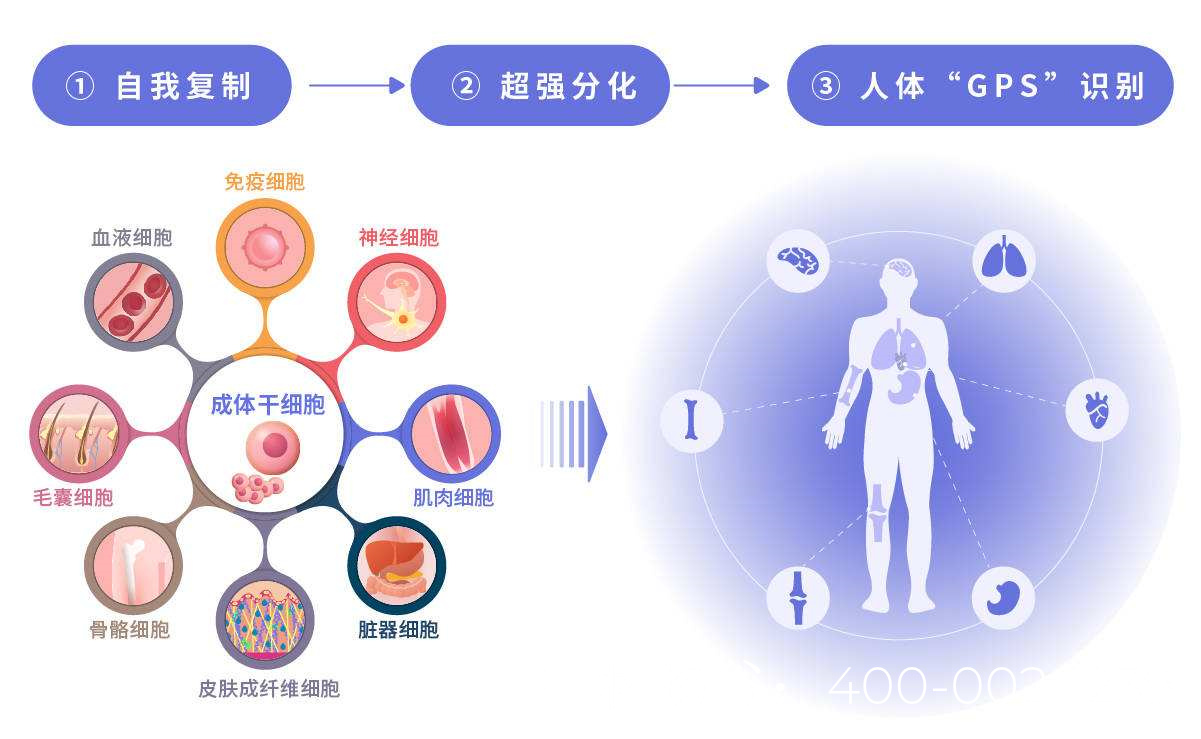
针对非先天性无精症的干细胞治疗主要基于三种机制:一是通过补充或替代受损的精原干细胞;二是通过旁分泌作用改善睾丸微环境;三是通过免疫调节减轻炎症反应。常用的干细胞类型包括精原干细胞(SSCs)、间充质干细胞(MSCs)、胚胎干细胞(ESCs)和诱导多能干细胞(iPSCs)等。
精原干细胞移植是最直接的策略。理论上,将健康供体的SSCs或患者自身体外扩增的SSCs移植回睾丸生精小管,可重建精子发生过程。2019年日本学者成功将小鼠iPSCs分化为功能性精子并产生健康后代,为人类研究提供了重要参考。然而,人类SSCs的体外培养和定向分化技术仍不成熟,且存在伦理争议。
间充质干细胞疗法因其易获取、低免疫原性和多向分化潜能而备受关注。MSCs可通过分泌血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)等细胞因子,促进睾丸血管新生、抑制纤维化、支持支持细胞功能。动物实验显示,骨髓或脐带来源的MSCs移植能部分恢复化疗损伤大鼠的生精功能,提高精子数量和活力。
未来发展方向
联合治疗策略可能提高疗效。例如,干细胞移植结合生长因子(如GDNF、FGF2)局部递送、低强度脉冲超声刺激或高压氧治疗,可能协同改善睾丸微环境。2023年一项动物研究显示,MSCs联合外泌体治疗比单用MSCs更能促进生精上皮修复。
生物材料工程为干细胞治疗提供新工具。三维打印的睾丸类器官、仿生支架可模拟生精小管结构,提高干细胞存活和分化效率。科学家正在开发温度响应型水凝胶作为干细胞载体,实现精准可控释放。
基因治疗与干细胞技术的结合也展现出潜力。对于特定基因突变导致的获得性生精障碍,可在体外对患者干细胞进行基因校正后再移植回体内。
展望未来,随着单细胞测序、类器官培养和基因编辑技术的进步,个性化干细胞治疗非先天性无精症可能在未来5-10年内取得突破。但在此之前,需要更多严谨的临床前研究和规范的临床试验来验证其安全性和有效性。