视神经由数量众多的视网膜神经节细胞轴突汇聚而成,它作为人类中枢神经系统的一部分,发挥着将视觉信息从视网膜传递到大脑的重要作用。视神经一旦受到损伤,往往会造成视功能下降、色觉减弱,甚至视力丧失等严重后果。
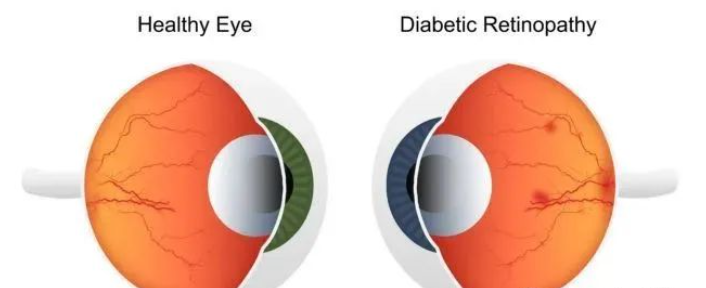
糖尿病视网膜病变最常见的早期临床表现包括微动脉瘤形成和视网膜内出血。微血管损伤导致视网膜毛细血管无灌注、棉絮斑、出血数量增加、静脉异常和视网膜内微血管异常 (IRMA)。在这个阶段,血管通透性增加会导致视网膜增厚(水肿)和/或渗出液,从而导致中心视力下降。增殖期导致视盘、视网膜和虹膜以及滤过角上的新血管增殖。这些新血管然后分别导致牵引性视网膜脱离和新生血管性青光眼。此时DR患者可能出现一些症状,具体依赖于眼部疾患的类型,例如,玻璃体积血导致的帷幕样遮挡、玻璃体积血消退过程中的飞蚊症,以及不能屈光矫正的视力下降、失明等,并且仍然是全球工作年龄成年人失明的主要原因。在糖尿病患者中,2020年DR的全球患病率估计为22.27%,威胁视力的DR患病率为6.17%。
糖尿病是一种日益严重的全球疾病,国际糖尿病联合会估计,到2021年,全球糖尿病患者人数将达到5.37亿,预计到2030年将达到6.43亿,到2045年将达到7.83亿。因此,DR在未来几年将成为一个更具挑战性的健康问题,并且在疾病的各个阶段都需要新的治疗方法。
目前的临床分类主要基于微血管病变,但糖尿病会对视网膜的脉管系统、神经元和神经胶质造成损害是公认的。
糖尿病视网膜病变的临床分类
临床上,DR根据解剖学特征和眼底照片上可检测到的血管病变的存在和严重程度进行分类(见图1)。
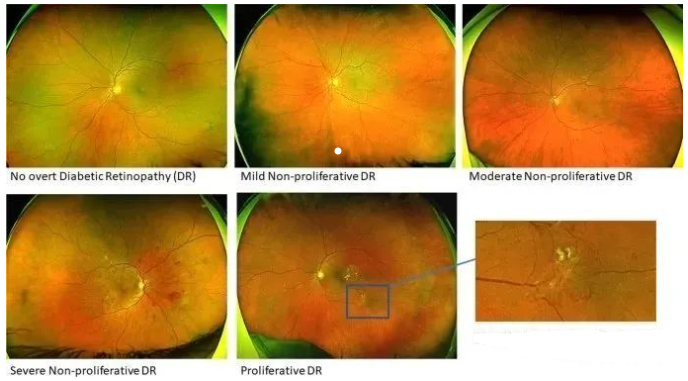
图1:根据DR的国际分类,显示糖尿病视网膜病变 (DR) 五个阶段的超广角眼底图像
第一级是“无视网膜病变”(指视网膜眼底图像中没有“明显的”视网膜病变)。
第二级“轻度NPDR”,其特征在于仅微动脉瘤。两组在几年内发生重大进展的风险都非常低。
第三级,“中度NPDR”,其特征不仅仅是微动脉瘤,例如存在视网膜内出血和/或硬性渗出物和/或静脉串珠,但低于重度NPDR;该组进展的风险显著增加。
第四级,“重度NPDR”,具有以下任一特征:四个象限各有20次以上的视网膜内出血;至少两个象限出现静脉串珠,至少一个象限出现视网膜内微血管异常 (IRMA),但没有增殖性视网膜病变 (PDR) 的迹象。

造成糖尿病视网膜病变的主要因素
视网膜神经血管单元完整性的进行性丧失是疾病发病机制的核心要素。视网膜缺血和炎症过程驱动相互关联的病理,例如血视网膜屏障破坏、液体积聚、神经胶质增生、神经元丢失和/或异常新血管形成。
长久的血管扩张导致了微动脉瘤和血管结构上的改变:基底膜增厚、周细胞变性和内皮细胞增生。周细胞变性破坏了毛细血管的完整性,继而损害血-视网膜屏障,导致了管腔缩窄和血流改变,到DR后期出现了视网膜缺血及新生血管。一旦出现新生血管则标志着进入增殖性糖尿病视网膜病变(PDR)。视网膜新生血管及纤维化是PDR的特征,其与VEGF、Ang-2等多种因素有关。
防治手段
1. 控制血糖、血脂,以保护血-视网膜屏障,降低微血管并发症风险,但仍无法阻止DR的发生发展。
2. 抗VEGF药物:此类药物主要代表有Lucentis和Conberept 两种。通过对VEGF的拮抗作用从而 抑制新生血管的产生、使减视网膜微血管渗漏轻,使视网膜水肿减轻,其在眼内新生血管类疾病的临床治疗中取得较确切的疗效,但其作用的时间较短,存在一定的全身及眼部并发症风险。
3. 激光治疗:是通过破坏视网膜外层,降低其耗氧量和新陈 代谢,使得内层获得更多的营养供给和氧,以减少新生血管,从而延缓增殖性病变的发生、发展,但它是一项破坏性治疗,仅能延缓病程,治标不治本。
4. 玻璃体手术治疗:是目前治疗PDR较为有效的方法,但手术存在风险,多是用于DR发展到晚期的患者,其可以改善部分患者视功能,但无法修复已造成的损害和改变疾病的发展。不难看出,目前对于DR的治疗手段非常有限,而且缺乏针对其早期微血管损害及发病机制的治疗措施。

干细胞治疗视网膜血管病变
通常,安全,生理稳定,具有高成本效益并且针对视网膜细胞再生的理想的RD-对抗策略是有吸引力且迫切需要的。幸运的是,干细胞,包括视网膜祖细胞(RPC),胚胎干细胞(ESC),诱导多能干细胞(iPSC)和神经干细胞(NSC),能够自我更新和多向分化。对生物医学应用进行了广泛研究,以满足临床转录的严格要求。通过替代变性细胞和/或提供营养支持,已经在各种RD动物模型中进行了许多基于干细胞/祖细胞疗法的成熟临床前研究,结果表明在RD的临床治疗中具有巨大的潜力。最近,已经发现许多类型的干细胞,例如脂肪,骨髓和脐带间充质干细胞,可以分泌具有低毒性和免疫排斥风险的多功能外泌体,并且通过传播大量的干细胞而具有巨大的免疫治疗和药物递送潜力生物分子与特定细胞。这意味着干细胞由于其分泌的纳米级外泌体的优势,将获得更多的牵引力,作为有前景的RD治疗方法。随着干细胞研究的不断深入,其在临床治疗研究也取得了飞速的发展。
干细胞概述
ECFC内皮集落形成细胞;MAC骨髓血管生成细胞;NSC神经干细胞;ASC脂肪基质/干细胞;iPSC诱导的多能干细胞;RPC视网膜祖细胞。众多细胞当中对糖尿病视网膜病变最为颇深的还是要属神经干细胞了。
神经干细胞(neural stem cell)是指存在于神经系统中,具有分化为神经元细胞、星形胶质细胞和少突胶质细胞的潜能,具有诱导分化成视网膜各类细胞的潜能,可能替代已变性的细胞;其分泌的细胞因子为周围细胞提供营养,并上调抗凋亡基因,延缓视网膜凋亡,同时能够保护视网膜血管及促进神经突触行程,较视网膜组织具有更好的可塑性及移行能力,有助于损伤视网膜的修复。
神经干细胞移植治疗糖尿病视网膜机制
近年来,神经干细胞用于DR动物实验已有较多文献报道,结果表明神经干细胞对糖尿病视网膜病变有良好的保护和修复作用,主要体现在:
1.通过靶向输注的方式给药,将细胞种植到视神经受损部位;
2.受损细胞可被神经干细胞修复替代,有研究发现,神经干细胞注射后,其能够向受损的视网膜进行迁移,并能表达星形胶质细胞和光感受器细胞的标志物;
3.保护神经作用,延缓或减轻视网膜组织的损伤:分泌神经营养因子,在DR动物模型中,注射神经干细胞后血-视网膜屏障功能和视网膜组织结构可有效地被改善;
4.向组织受损部位和炎症迁移的功能,其可以快速地被招募到损伤部位,继而促进神经和血管的修复,另外局部炎性反应通过旁分泌机制被抑制,从而保护和营养细胞组织,促进创伤的愈合。
临床研究
2016年一项临床前动物模型研究显示,视网膜下移植干细胞有阻断眼底蜕变的作用。玻璃体内注射移植干细胞可减轻视网膜血管渗出、抑制血管凋亡、闭塞,视网膜电图恢复正常。Science Advances期刊上刊登了一项基于人类诱导多能干细胞的新的再生医学方法,或有可能修复患有早期视网膜血管功能障碍的2型糖尿病患者的眼部血管,更好地管理2型糖尿病的血管健康并发症。

在这项新的研究中,来自美国印第安纳大学医学院和阿拉巴马大学伯明翰分校等研究机构的研究人员将糖尿病患者和非糖尿病患者的外周血细胞通过基因工程手段重编程为人类诱导性多能干细胞(hiPSC),然后将hiPSC分化为特定的血管修复细胞——一种表达KDR、NCAM1和APLNR的特定的中胚层细胞亚群(KNA+中胚层细胞)。该细胞亚群经富集后产生类似于ECFC(endothelial colony forming cell,内皮细胞集落形成细胞)的具有血管修复特性的内皮细胞。而内皮细胞通常存在于血管、淋巴管和心脏内壁,是调节血管功能和炎症反应的主要组成部分,能够控制血流并调节蛋白从血液转移到组织中。
NRP-1+CD31+内皮细胞在功能上类似于ECFC
研究人员将这种hipsC衍生的血管修复细胞注射到2型糖尿病(T2D)视网膜功能障碍的动物模型后,他们发现在血管灌注恢复后,视力和神经视网膜电图均有明显改善。也就是说这种治疗方法能增强机体形成功能性血管的能力,而且能够逆转受伤视网膜血管的退化。

RD是全世界失明的主要原因,它主要是由于RPE和感光细胞的变性所致。因此,科学家通过替代变性视网膜细胞和/或通过补充营养因子防止视网膜变性,将祖细胞/神经干细胞移植疗法应用于RD治疗,尤其是基于RPC,ESC,NSC,iPSC的疗法的使用。研究表明干细胞治疗DR具有较好的安全性,并显示显著的降血糖和调节炎症反应的作用,对视力、视觉电生理指标以及眼底病理改变具有一定的改善趋势。
-END-
素材源于网络,内容有改动
版权归原作者所有,侵删!
下一篇:脑中风怎么治愈好得快

