2019年发表在 Nature Reviews Genetics上的一篇综述:诱导多能干细胞在疾病建模和药物发现中的应用Induced pluripotent stem cells in disease modelling and drug discovery | Nature Reviews Genetics

摘要:
十多年前,诱导多能干细胞 (iPSC) 的获取激发了人们对开发人类疾病新模型、增强药物发现平台和更广泛使用自体细胞疗法的广泛热情。使用 iPSC 定向分化的早期研究通常揭示了单基因疾病中的细胞水平表型,但转化为组织水平和器官水平疾病需要开发更复杂的 3D 多细胞系统。类器官和人类-啮齿动物嵌合体更准确地反映了复杂组织的不同细胞生态系统,并被应用于 iPSC 疾病模型,以概括人类疾病的病理生物学,包括传染病、遗传疾病和癌症。
背景
10多年前,来自皮肤或血液的成熟人类体细胞可以被重新编程为多能状态,然后沿着不同的细胞谱系分化,这一发现为在广泛的疾病中进行基于细胞的个性化自体治疗提供了理论机会。对基于诱导多能干细胞(iPSCs)的针对患者治疗的热情随着之后精确DNA编辑的快速进步而上升。然而,为了开发优化的疾病模型作为发现新药的平台,人类患者来源的iPSCs必须有效地分化为能真实地概括疾病细胞和组织的特征的细胞状态。因此,IPSC衍生产品的临床应用在很大程度上依赖于定向分化、细胞状态转换和组织工程的最新技术水平。十年后的今天,我们在实现这些目标方面处于什么地位呢(图1)
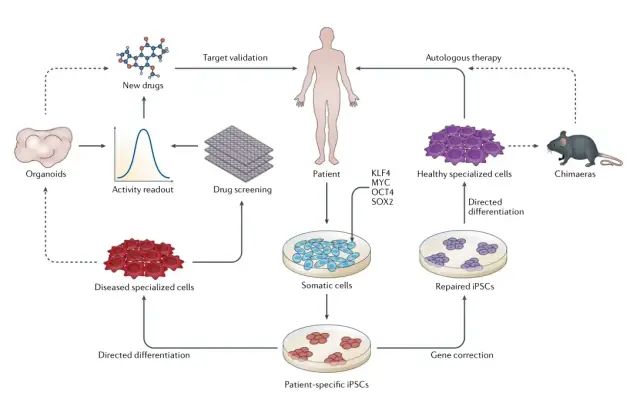
图 1 |基于 iPSC 的治疗进展。在发现诱导多能干细胞 (iPSC) 后,提出了基于细胞的治疗和药物发现的方法 22。在这里,我们说明了过去十年在实现这些目标方面取得的进展。重编程方法的迭代改进提高了 iPSC 诱导的效率和使用中 iPSC 细胞系的质量。作为向基于自体 iPSC 的治疗迈出的一大步,使用 CRISPR-Cas9 技术的基因编辑已广泛应用于 iPSC,以修复引起疾病的遗传损伤。正如本综述中所讨论的,定向分化方法取得了显著进展,这种方法可以用来获得基因校正的、终末分化的细胞。然而,除了极少数例外 150,广泛的基于 iPSC 的自体细胞疗法仍然遥不可及。嵌合模型中移植和定向分化的优化以及生成临床级细胞的效率和可扩展性的改进将继续朝着在不同器官系统中进行自体治疗的目标前进。从患者来源的 iPSC 分化而来的未校正细胞已被用于药物筛选和验证研究,主要使用细胞水平读数(readout) 23。目前,在基于 iPSC 的系统中确定的少数候选药物正在人体试验中进行研究23。我们预计,使用有机化合物的基于iPSC的疾病模型的日益复杂将通过改进临床前药物筛选、设计和验证,利用与疾病高度相关的读数来加速候选疗法进入临床试验,从而整合到这些药物发现方法中。图改编自 Springer Nature Limited 的参考文献 22。
自从1998年首次分离出人类胚胎干细胞(ESCs)以来,很多工作都集中在使胚胎干细胞分化成成熟组织上, 以实现同种异体细胞治疗的长期目标。开发了将 ESC 分化为神经细胞 6、7、心肌细胞 8、胰腺 β 细胞 9 和造血细胞 10、11 的方案,这些细胞被用于早期基于 ESC 的疾病模型 12-14。鉴于原发疾病干细胞系的分离受到体外受精12中植入前遗传学诊断要求的限制,我们利用现代技术如RNA干扰或同源重组13,14,对正常胚胎干细胞系进行遗传操作,引入与疾病相关的分子缺陷。这些开创性的研究维持了使用胚胎干细胞模拟疾病的乐观态度;毕竟,这些人类系统没有模型生物疾病研究所固有的进化差异的限制。
重编程技术的出现使得在已建立的定向分化方案中能够使用疾病特异性iPSC,从而绕过了ESC中疾病建模的许多限制,例如需要基因编辑15-18(图1)。在一系列疾病中发现了从患者特有的iPSCs分化而来的细胞水平的表型,包括脊髓性肌萎缩症患者的iPSCs运动神经元分化受损15;从诊断为精神分裂症的患者的iPSCs衍生的神经元的神经元连接、轴突形成和突触蛋白表达减少19;家族性长QT综合征患者的心肌细胞的动作电位延长16;家族性自主功能障碍患者的iPSCs的神经分化缺陷20;以及来自Fanconi贫血患者的造血祖细胞的克隆形成减少。这些表型看起来稳健、可复制、与疾病相关,在基于细胞培养的系统中是可测量的,并反映了细胞水平固有的疾病。
尽管这些系统显著促进了对模型疾病背后机制的理解,但人类疾病发生在复杂的多细胞系统的背景下,其中细胞、细胞外基质、组织、器官系统和病原体之间发生相互作用。因此,目前正在开发更复杂的基于 iPSC 的分化系统,以忠实地概括人类组织水平和器官水平的功能障碍,这些系统最近已被纳入疾病建模、药物筛选和宿主-病原体相互作用的研究。此外,异种移植的进步促进了更复杂的 iPSC 衍生的人体组织用于研究疾病。然而,在 iPSC 中进一步推进疾病建模存在广泛普遍的障碍,包括胚胎或胎儿身份在衍生组织中的持续存在以及 iPSC 系的背景遗传变异性。
在这里,我们评估了使用 iPSC 对人类疾病进行建模所取得的进展,讨论了最近的研究,这些研究定义了使用 iPSC 进行疾病建模的当前前沿范围,并回顾了阻碍进一步进展的挑战。iPSC 向更复杂的 3D 组织分化和重新定型的改进以及 iPSC 衍生细胞移植形成嵌合动物,正在加速该领域向高度可靠的多细胞疾病模型的方向发展。
此外,随着 iPSC 研究前沿的发展,它也得到了扩展,以至于现在正在使用基于 iPSC 的复杂模型来研究宿主-病原体相互作用。我们讨论了我们认为推动 iPSC 研究更接近期待已久的治疗突破的最新进展。在综合这些创新的影响时,我们提出了一个支持 iPSC 持续乐观的案例,因为它即将产生可靠的疾病模型、经过验证的药物和基于细胞的疗法
类器官:培养皿中的复杂组织
在分离人类 ESC 之后,分化方案通常会调节 2D 组织培养或胚状体内暴露于形态发生素( morphogen),目的是重述早期胚胎发生的模式事件,首先指定所需的胚层,然后是特定的目标谱系 6-11。在开发出患者特异性 iPSC 后,这些技术被应用于疾病建模,以获得受影响的细胞谱系 17。在大约 6 年的时间里进行了一系列的研究,从2008年起,描述了基于iPSC的多种疾病模型的细胞级表型22。尽管使用这些系统的药物筛选工作确定了候选的小分子疗法16、20、23-25,但不幸的是,到目前为止,从基于细胞的系统到人体试验的转换还没有满足早期的希望和期望。
随着iPSC衍生的类器官26、27的发展,iPSC疾病建模方面取得了重要进展。类器官是来自干细胞的三维多细胞聚集体,它们分化并自组织起来,概括了成熟组织的结构特征和细胞与细胞的相互作用28。用于引导类器官从 PSC 分化的可溶性和生物物理线索已经逐渐完善,以产生越来越复杂的“盘中组织”26,27。此外,研究人员已经实现了特定器官区域的分化,例如大脑和胃肠道 29、30。在这里,我们回顾了人类 iPSC 类器官技术的关键前沿研究 (表1,2),并讨论了这些进展在更广泛的 iPSC 疾病建模和药物发现方案中的适用情况(图 2)。
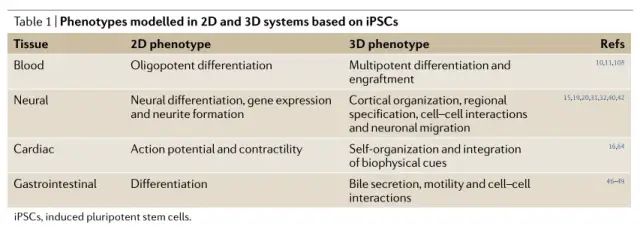
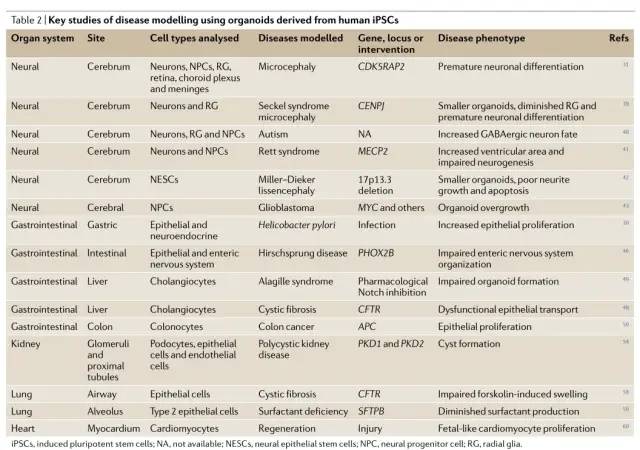
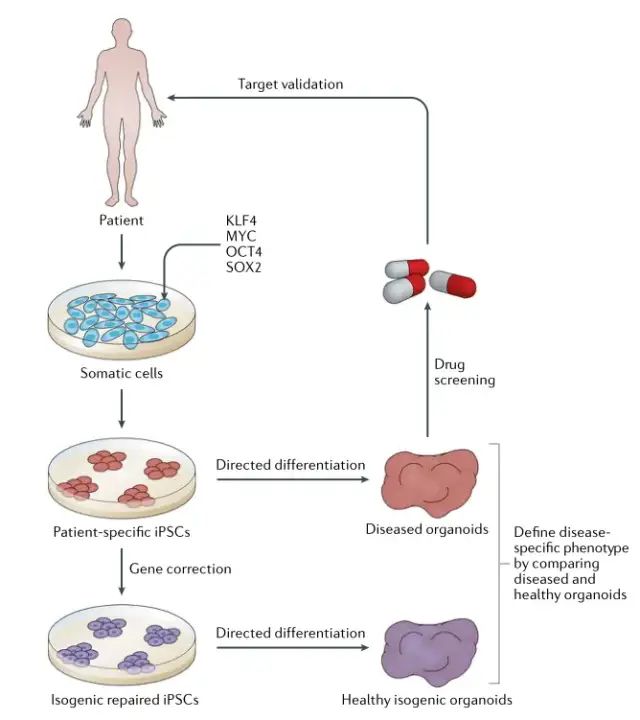
图 2 |来自 iPSC 的类器官在疾病建模和药物发现中的应用。分化日益复杂的多细胞和多样化的类器官系统取得了显著进步。我们提出,类器官与患者衍生的诱导多能干细胞 (iPSC) 的平行分化以及基因校正的等基因对照 iPSC 将允许将类器官水平的疾病表型归因于特定的分子病变。一旦建立了清晰的类器官水平读数,患病类器官就可以用于药物筛选和验证研究。
神经类器官。PSC 的神经分化已被深入研究,因为神经外胚层似乎是从维持多能性的培养条件中去除 PSC 后诱导的默认细胞命运6,7。ESC 和 iPSC 的早期研究利用神经分化方法来模拟神经系统疾病15、19、20。
作为向前迈出的一大步,源自人类 PSC 的 3D 大脑类器官的开发建立在这些基础神经分化方案的基础上,但还提供了指导性的形态发生线索,随后在悬浮生物反应器中生长长达 70 天 31,32。这些类器官包含具有皮质自组织和特定前脑和后脑区域的功能性神经元,并且值得注意的是,甚至包括未成熟视网膜和脉络丛的分化31, 32。这种方法的改进导致了对大脑进一步特定区域的分化,例如海马和小脑,功能性感光器和星形胶质细胞的衍生以及皮质折叠的诱导29,33-38。除了这项创新,与之前研究相比,这种精心设计的类器官在结构上的可变性可能更小。
神经类器官的复杂性已被用来模拟各种单基因和多基因神经、发育和精神疾病,这些疾病共同为神经疾病的病理生物学提供了深刻的见解。由于 CDK5RAP2中的复合杂合突变,人类 iPSC 衍生的神经类器官最初被用于模拟小头畸形,CDK5RAP2 编码在有丝分裂期间定位于纺锤体极的中心体蛋白。这导致发现患者特异性神经类器官经历了过早的神经上皮分化,并显示出异常的径向胶质细胞方向和较小的分化神经组织区域。在源自 Seckel 综合征患者的 iPSC 的神经类器官中观察到类似的表型,该患者由 CENPJ39 突变引起,CENPJ39 是另一种在微管组装和成核调节中起作用的中心体蛋白。自闭症患者的 iPSC 衍生的神经类器官显示出正常的早期神经元分化,但由于转录抑制因子 FOXG1 的过度产生,抑制性 GABA 能神经元的命运相对于谷氨酸能的命运相对增加,这表明这种分化失衡是自闭症发病机制的潜在机制。使用源自 Rett 综合征患者的带有 MECP2 突变的 iPSC,神经类器官显示出神经发生受损和神经元迁移减少。来自 Miller-Dieker 综合征患者的 iPSC 的皮质类器官,这是由 17p13.3 处的杂合缺失引起的,显示出神经突生长不良、心室区凋亡和神经元迁移受损 42。
最近,源自人类 PSC 的神经类器官已被用作研究脑肿瘤的平台。用载体转导含有神经干细胞和祖细胞的脑类器官,以引入脑肿瘤中常见的突变,导致转导细胞过度生长。因此,与二维系统相比,神经类器官增强了我们对神经疾病病理生物学的理解。
胃肠道和肝脏类器官。在过去的 10 年里,人们对胃肠道类器官进行了深入研究28。肠道类器官可以来源于成人肠道干细胞44 以及 PSCs45。通过使用严格的形态发生素暴露时间表来指定内胚层和前肠和后肠命运,类器官可以从含有功能性肠上皮细胞以及杯状细胞、潘氏细胞和神经内分泌细胞的人类 PSC 中产生。随后,通过调节视黄酸信号来定义后前肠分化,可以生成具有复杂胃窦上皮结构的胃窦类器官,这些类器官可用于模拟幽门螺杆菌感染。当PSC来源的神经前体细胞被结合到肠道器官中时,又增加了一层复杂性,形成了能够调节收缩波的功能性肠道神经系统46。神经细胞迁移到原始肠道的缺陷是先天性巨结肠症的基础,由于运动功能受损,该病经常需要手术切除大片无神经节细胞的肠道。人类iPSC衍生的肠道器官与PHOX2B基因缺陷的神经前体细胞相结合--在人类中,这种基因突变会导致肠道神经完全丧失--表明肠道神经系统的组织受损。总而言之,这些研究带来了iPSC衍生的胃肠类器官的先进的区域性分化和复杂性,并导致了疾病模型的显著改进。
2D分化方案已被证明在从iPSCs产生肝细胞治疗各种肝病方面是有效的47。最近,来自患有肝胆疾病的IPSCs的胆管细胞已经在3D器官系统中获得48,49。已经描述了两种类似的分化方案,都是从最初定向分化为最终的内胚层和肝母细胞开始,然后在3D培养中定向分化为胆管细胞样细胞48,49。这些胆管细胞器可以排出胆汁酸,并具有功能性分泌作用48,49,使得能够建立Alagille综合征的模型,Alagille综合征是一种由Notch信号中断引起的胆管形成障碍的情况。在从多囊肝病患者分化而来的胆管细胞类器官中,合成的生长抑素类似物奥曲肽减小了类器官的大小,这与该药物在多囊肝病患者中的作用一致。从携带F508del CFTR突变的囊性纤维化患者的iPSCs中提取的胆管细胞器显示氯离子转运受损,并减少了CFTR依赖的Forsklin诱导的肿胀,这种肿胀可通过CFTR校正药物Lumacaftor(也称为VX-809)48,49挽救。在每一种情况下,复杂疾病表型的建模都是通过开发3D器官来实现的。
源自 PSC 的胃肠道类器官可用于模拟肠道肿瘤。后肠内胚层的精确形态发生素定向分化可以产生具有包含杯状细胞、上皮细胞和神经内分泌细胞的形态隐窝的结肠类器官。与对照类器官相比,来自具有 APC 基因种系突变的家族性腺瘤性息肉病患者的 iPSC 评定的结肠类器官具有增加的 β- 连环蛋白核定位和增殖。
肾脏类器官。人类 iPSCs 的发现提高了对功能性肾组织潜在分化用于自体移植的热情;因此,iPSC 的肾脏分化和肾脏疾病的建模受到了广泛关注51, 52。2015 年首次报道了从 iPSCs 衍生的人肾脏类器官作为包含肾单位成分(肾小球和近端和远端小管)以及基质和脉管系统的复杂 3D 结构。随后,研究表明 iPSCs 可以分化为输尿管芽祖细胞样细胞,在三维培养后,这些细胞发育成原始输尿管芽,可用于模拟多囊肾病 (PKD)52。另一种方法首先将人类 iPSCs 分化为三个维度的外胚层球体,然后通过抑制 GSK3β 信号传导将其分化为肾脏类器官。在该系统中,人类 iPSC 中 PKD1 或 PKD2 基因的基因消融导致异常囊肿的形成。从人类 iPSC 中生成肾脏类器官的方法在复杂性上不断进步,因此可以合理地预期肾脏疾病模型的进一步完善 55, 56。作为一种替代系统,依赖于层流的功能性血管化 iPSC 衍生肾小球模型为未来的功能性肾小球疾病建模提供了一个平台57。
肺类器官。最近的两项研究通过将人类 iPSC 定向分化为能够随后形成近端或远端气道细胞的 NKX2.1+ 气道祖细胞,突出了人类 iPSC 衍生的肺类器官在疾病建模中的力量 58、59。NKX2.1+ 祖细胞在三个维度的低 WNT 活化培养导致可重复形成含有分泌细胞、杯状细胞和基底细胞的近端气道类器官 58。来自 F508del CFTR 突变纯合子囊性纤维化患者的 iPSC 有效地形成了近端气道类器官,但与来自对照人类 iPSC 系的类器官相比,毛喉素诱导的肿胀受损58。将此表型归因于 CFTR 功能障碍,iPSC 中 F508del 的基因校正挽救了毛喉素诱导的肿胀 58,从而揭示了基因编辑在 iPSC 疾病模型中确认基因型-表型关系的能力。
人类 iPSC 衍生的 NKX2.1+ 肺祖细胞也可以在 3D 培养中分化为远端肺泡类器官59。这些肺泡类器官含有功能性 2 型肺泡上皮细胞,这些细胞含有层状体并分泌表面活性蛋白 59。使用来自缺乏表面活性剂蛋白 B 的患者的 iPSC,研究人员发现分化的 2 型肺泡上皮细胞不包含层状体或合成 SFTPB(也称为 SPB),这是一种可通过 Cas9 介导的 SFTPB 突变校正而逆转的表型 59。
心脏类器官。最近,自组织心脏类器官的开发取得了相当大的进展。iPSC 衍生的心脏类器官显示出胎儿样分化的特征,并已用于模拟损伤后的心肌细胞再生60。这一发现强化了这样一种观点,即源自 iPSC 的心肌细胞和其他组织通常表现出胎儿样分化,这可能会妨碍成人疾病的建模61-63。分化方案的逐步完善最近产生了具有中央空腔的复杂心肌细胞类器官64。此外,iPSC 已被用于设计 3D 心肌组织,以评估机械力、新陈代谢和细胞外基质对心肌细胞成熟65、66 的影响。这些研究结合了使用 iPSC 的组织工程的各个方面。有趣的是,iPSC 还被用于使用 3D 芯片器官技术对心肌病进行建模,这种策略在许多其他疾病系统中获得了关注,它提供了对血管灌注建模的附加维度26、57、67、68。我们已经描述了一些在衍生越来越复杂的人类 iPSC 衍生类器官方面取得的创新进展,以努力实现基于自体 iPSC 的治疗的目标(图 2;表 2)。随着该领域发展,这些类器官系统在二维系统中用 iPSC 建模疾病的基础研究基础上,对疾病发病机制产生了宝贵的洞察力。在其中许多研究中,iPSCs 中的基因校正可以在类器官水平逆转疾病表型,为这种方法在未来可应用于基于自体 iPSC 治疗实体器官疾病的原理提供了证据。应该注意的是,相对于 2D 培养系统,采用基于类器官的系统存在利与弊。为解决这些模型的内在产量下降而设计的新型类器官培养技术应被广泛应用于未来可能用于基因组或药物筛选33,66。必须考虑由类器官组织变化和实验与 iPSC 细胞系之间的差异引起的假定批次效应,并在实验设计中纳入适当的质量控制。有限的氧气渗透限制了培养的增长,未来的系统将建立在灌注器官异种移植物的早期研究 69、70 的基础上。此外,影响 iPSC 分化的人类遗传变异会影响模型疾病患者和健康对照个体的类器官的比较 71, 72。未来的研究将平衡自组织和组织工程方法,以根据特定器官系统和病理生理过程定制类器官31,65。我们预计未来的研究将利用 iPSC 衍生细胞沿特定谱系分化,组装成更复杂和功能更强大的类器官和工程组织,以进一步了解组织和器官水平的疾病发病机制26,46,56,73
宿主-病原体相互作用的 iPSC 模型
尽管最早的基于 iPSC 的疾病模型专注于遗传疾病 15,17,但已经表明,从人类 iPSC 最终分化的细胞容易受到人类病原体的感染,这为探索宿主-病原体相互作用开辟了新的前沿。基于人类 iPSC 的系统克服了传染性致病性和炎症反应的物种特异性限制,这些限制在以往阻碍了将模型生物的发现转化到人类上74,75。此外,基于 iPSC 的系统最近提供了筛选新型抗菌药物的平台76。
使用iPSCs在细胞水平上模拟感染。从人iPSCs分化而来的细胞可能是病原性病毒感染的靶点。一项早期的研究使用了T细胞感染HIV的模型,表明iPSC来源的自然杀伤(NK)细胞可以通过靶细胞的直接细胞毒性、细胞因子的分泌和抗体依赖的细胞细胞毒77介导强大的抗HIV活性。通过在人iPSC来源的NK细胞78中表达融合到CD3ζ胞内结构域的胞外CD4域,可以进一步增强HIV在靶细胞中的复制。利用CRISPR-Cas9,将CCR5del32突变引入人iPSCs中,使分化的单核细胞对HIV感染产生抗药性,为基于iPSC治疗HIV79提供了证据。在单纯疱疹病毒1型(HSV-1)脑炎模型中,从TLR3或UNC93B缺陷患者的iPSCs分化出的神经元对HSV-1感染的敏感性增加,这与这些患者对HSV-1脑炎的敏感性一致。人类iPSC来源的巨噬细胞也被用来模拟登革病毒感染81。
在3D系统中对病毒感染进行建模。这些关于病毒与人类iPSC来源细胞相互作用的研究为最近使用类器官的研究奠定了基础(表3),其中几项及时的研究模拟了寨卡病毒感染。两篇里程碑式的研究展示了iPSC衍生的有机化合物的价值,它们表明寨卡病毒感染会损害人类iPSC衍生神经球的生长并导致细胞死亡82,83。随后,据报道,最近的寨卡病毒分离株由于中心体的破坏而诱导了人类神经球脑室区域的神经前体细胞的分化,从而促进了有丝分裂平面的错误定向84。最近,寨卡病毒再次被证明损害器官的生长,但感染也在大脑折叠的模型中诱导了无脑样表型37。已有研究表明Ax1蛋白在寨卡病毒感染神经前体细胞(NPC)85中起重要作用。然而,切除脑器官中的Axl并不影响寨卡病毒的感染86。这些观察通过设计一种微型旋转生物反应器系统来扩展--这是神经类类器官31所必需的--以通过定向分化刺激产生前脑、中脑和下丘脑类器官。该前脑分化系统用于在不同发育时间点模拟寨卡病毒感染,发现早期类器官中 NPC 的感染导致类器官大小显着减小、心室区厚度减小和心室结构扩张。这种微型旋转生物反应器系统可以作为未来使用神经类器官进行药物发现的平台。在另一项研究中,对人类 iPSC 衍生的 NPC 进行了筛选,以寻找能够阻断寨卡病毒感染并从受感染的 NPC 中清除寨卡病毒的化合物76;也就是说,人类 iPSC 衍生的前脑类器官被用于验证命中化合物抑制神经组织寨卡病毒感染的能力 76。
源自人类 PSC 的类器官已被用于模拟上皮组织的感染。人类 ESC 衍生的肠道类器官已被用于模拟轮状病毒病理生物学87。源自 PSC 的分支人类肺类器官的复杂系统已被用于模拟呼吸道合胞病毒感染,其中受感染的上皮细胞发生膨胀和脱落,如同在人体组织中所见。这些研究证明了类器官系统在概括人类病毒感染方面的能力。
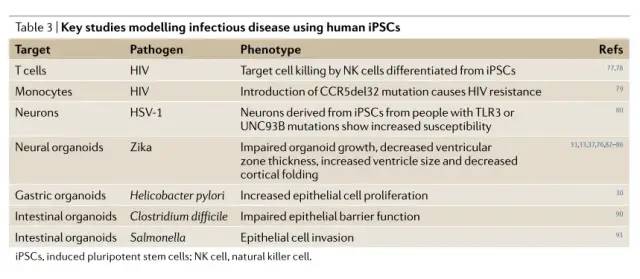
细菌感染。类器官已被用于模拟胃肠系统中的细菌感染。用幽门螺杆菌(H. pylori,)显微注射人胃窦类器官,并测量上皮细胞的形态和生化反应。H. pylori 与胃上皮密切相关,诱导 MET 磷酸化和上皮增殖,概括 H. pylori 感染性病理生物学的各个方面30,89。来自人类 ESC 的肠道类器官已被用于模拟艰难梭菌( Clostridium difficile)感染,这是医源性结肠炎感染的主要原因 90,91。产毒艰难梭菌与肠上皮细胞和受损的类器官屏障功能有关90。人类 iPSC 衍生的肠道类器官用于模拟沙门氏菌(Salmonella)感染 92。沙门氏菌注入与微绒毛相关的肠道类器官并侵入上皮细胞,在上皮细胞内形成含有沙门氏菌的空泡。含有成人样肠上皮细胞的人 ESC 衍生肠球用于模拟大肠杆菌菌株 O157:H7 (reF.93) 的感染。大肠杆菌在 PSC 衍生的肠上皮细胞中诱导转录炎症反应 93。
总的来说,这些研究表明人类 PSC 衍生系统可以模拟各种传染性病原体和器官系统的宿主-病原体相互作用。我们预计类器官系统的进一步复杂化,特别是通过免疫和炎症细胞的结合,将导致人类基于 PSC 的传染病模型的范围扩大。我们推测,由于宿主-病原体相互作用的物种特异性限制了将非人类模型的发现转化为临床相关疗法,人类 iPSC 模型将在未来在传染病领域发挥特别重要的作用。此外,扩展用于药物筛选的人类 iPSC 类器官模型将在新型抗生素和抗病毒药物的鉴定和验证方面取得重大进展 33,76。
人-动物嵌合体
虽然复杂性、成熟度和细胞多样性增加,但将基于类器官的疾病模型限制在组织培养环境中限制了对体内存在的循环、神经和免疫系统、激素和其他代谢介质相互作用的分析。此外,类器官依赖于培养中的自组织,缺少体内存在的许多形态发生线索。在模拟血液疾病时,体外分化系统很少包含造血分化和真正造血干细胞(HSCs)所需的生态位因子94,95。最近,这些限制已通过异种移植从人类 PSC 分化的细胞和类器官的进展得到解决。鉴于最近在许多疾病的临床前或临床环境中正在研究的基于细胞的疗法的爆炸式增长 96-100,基于 iPSC 的异种移植嵌合疾病建模已成为通过可靠地模拟人类疾病来推动这些进展的可靠工具(box 1;图 3)。在这里,我们专注于几个器官系统的关键研究。
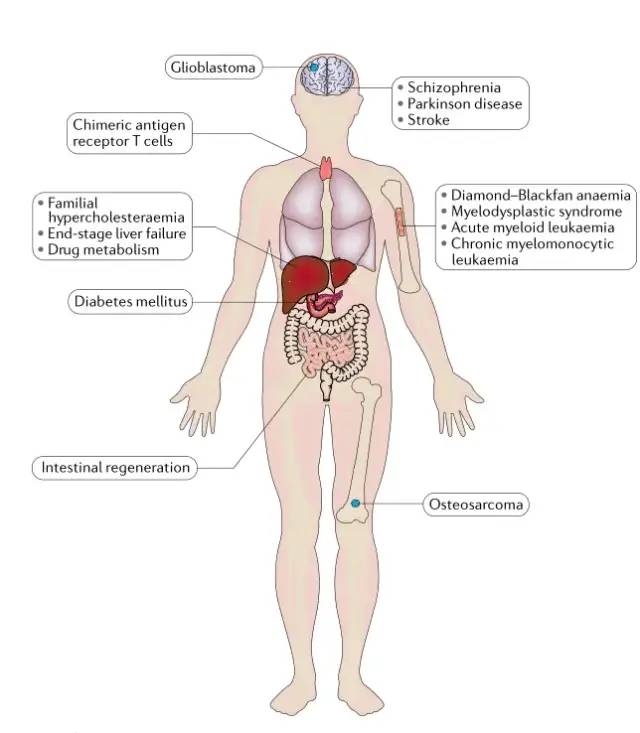
图 3 |基于 iPSC 的嵌合模型。人类诱导多能干细胞 (iPSC) 嵌合体模型的现状总结,说明被建模为嵌合体的组织和器官的多样性以及已在嵌合体中建模的疾病类别
Box 1 |异种移植 iPSC 细胞的注意事项 将人体组织移植到小鼠体内以产生嵌合模型的效率依赖于免疫缺陷小鼠宿主,这些宿主能够产生“人源化”小鼠。这项技术是由造血研究推动的,其中支持人类血细胞移植的模型极大地增强了我们对人类造血干细胞和祖细胞 (HSPC) 的理解141。自 1983 年首次报道 Scid 突变损害小鼠 B 细胞和 T 细胞发育 142 以来,反复添加损害宿主免疫的进一步突变增强了基因工程小鼠对人类造血移植物的接受性 141,143。三重突变体 NoD–Prkdcscid–Il2rgtm1Wjl 菌株可以接受来自人类诱导多能干细胞 (iPSC) 的重新指定的 HSPC 的移植 106-108,从而能够在照射后从 iPSC 形成造血嵌合体。然而,除了消除天然造血细胞为外源性移植物腾出空间外,辐照还会破坏造血微环境并导致遗传毒性 144。未来对嵌合小鼠中 HSPCs 功能的研究应利用不需要基因毒性调节的新模型,例如抗体介导的调节或 NoD-Prkdcscid-Il2rgtm1Wjl 小鼠在 Kit 中携带 W41 突变,可以在没有调节144,145。
免疫缺陷小鼠模型现在广泛用于使用人 iPSC 衍生细胞生成非造血嵌合体。此类株已被用于产生神经 122,126、肝 70、实体瘤 118,119 和胰腺 131 嵌合体。这些研究说明了免疫缺陷小鼠的适用性,不仅适用于基于 iPSC 的疾病建模,而且适用于组织工程和移植方法的开发。
造血嵌合体。造血性嵌合体。自从分离出人类ESCs以来,人们一直致力于利用定向分化来产生造血干细胞和祖细胞(HSPC),并有可能植入人源化的受体小鼠,作为血液病细胞治疗的第一步。最初的努力产生了具有受限髓系和红系血统潜力的造血祖细胞,类似于早期胚胎发育中在卵黄囊内出现的原始造血祖细胞10,11。最近,对描绘原始和确定的造血细胞命运的信号轴的微调(例如,activin–Nodal和WNT)已经能使由体外淋巴潜能94,101,102定义的最终样祖细胞(definitive- like pro-genitors)的定向分化。然而,即使是最复杂的旨在从PSCs获得确定的HSPC形态的定向分化方案也不能产生真正的HSCs,真正的HSCs具有高水平长期植入免疫缺陷小鼠的能力,这是产生嵌合体疾病模型所需的94,101。事实上,在体外没有转基因诱导的情况下,通过定向分化从PSCs获得可植入的HSCs仍然是一个难题103。
我们研究团队的目标是解锁通过PSCs定向分化衍生的HSPC的体内移植能力,以改进疾病建模和推进基于iPSC的造血治疗。基于小鼠胚胎干细胞来源的原始HSPC可以通过强制表达同源异型转录因子HOXB4(reFS104,105)而被重新鉴定为具有多系植入潜力和自我更新的明确表型,我们团队进行了体内转录因子的筛选,以驱动来自PSCs106的原始样人HSPC的植入。HOXA9、ERG、RORA、SOX4和MYB的表达可以在培养中扩增人iPSCs来源的原始样祖细胞,并在免疫低下的小鼠中短期植入髓系和红系细胞。我们使用这个系统,使用来自携带核糖体蛋白基因RPS19或RPL5突变的患者的IPSCs来模拟 Diamond–Blackfan 贫血(DBA)的先天性红系再生障碍性贫血(参考文献107)。将重新指定的人DBA iPSC来源的祖细胞植入产生嵌合小鼠的实验显示,红系分化明显受损,概括了人类DBA表型107。使用重新指定的、可扩展的祖细胞来筛选可以挽救DBA患者细胞中的红细胞生成的小分子,确定自噬诱导剂SMER28是一种也能够在嵌合小鼠107中挽救红细胞生成的候选疗法。最近,我们的团队报道了转录因子介导的特定造血祖细胞从人的iPSCs到可植入的、自我更新的、多系的HSCs108。鉴于人类iPSC系来自许多遗传性血液疾病13,109-111,我们认为该系统将支持未来对血液疾病的更深层次的建模。由于HSPC的体外生产在该系统中仍然是低效的,移植治疗仍然取决于进一步的发展,并可能与人类HSPC异种移植的进一步发展相衔接(BOX1)。
癌症模型的嵌合体。几年来,将肿瘤移植到免疫缺陷小鼠模型中一直是癌症研究中的一项关键技术。在人类血液系统恶性肿瘤的iPSC模型113,114中,已经利用了形成造血嵌合体的能力。携带MLL(也称为KMT2A)基因易位的急性髓系白血病(AML)母细胞可以通过去除异常的MLL驱动的DNA甲基化而有效地重新编程为多能性细胞,并有效地分化为非造血系113。然而,在定向分化为造血祖细胞后,这些细胞在培养和体内移植中表现出异常的自我更新,就像AML113一样。该系统被用来模拟人类AML的克隆结构,识别单个iPSC衍生的亚克隆113的不同药物敏感性。一项同时进行的研究从患有从正常造血、非恶性克隆性造血和低级别和高级别骨髓增生异常综合征到AML114的各种疾病的患者中获得了人类iPSC系。这项研究报道,只有从AML原始细胞重编程的iPSCs定向分化产生的造血祖细胞才能被异种移植为白血病114。有趣的是,与AML相反,B急性淋巴细胞性白血病(B-ALL)原始细胞对重新编程为多能细胞具有抵抗力115。然而,最近有报道称,MLL-AF4(也称为AFF1)融合癌基因在人iPSCs造血祖细胞中的瞬时表达可以诱导多系植入,最终在长期植入后发展为B-ALL,从而提出了一种利用人iPSCs116建立人B-ALL的新模型。最近,从慢性粒单核细胞白血病患者中重编程的iPSC被用于生成含有可植入白血病细胞的畸胎瘤117。
基于人类iPSC的嵌合体也被用来模拟实体肿瘤。人类的重编程的iPSC 的胶质母细胞瘤细胞消除了具有肿瘤抑制功能的基因启动子的高甲基化 118。在 iPSC 定向分化为 NPC 后,这些细胞保留了恶性潜能,当异种移植到小鼠纹状体中时形成侵袭性肿瘤 118。从携带种系 TP53 突变的 Li-Fraumeni 综合征患者获得的 iPSC 分化成成骨细胞,这些患者易发生各种实体和液体恶性肿瘤,在免疫缺陷小鼠皮下注射后形成骨肉瘤样肿瘤 119。未来使用源自 iPSCs 和异种移植到小鼠中的类器官的研究可以为实体瘤的发生和进展提供新的见解。
神经嵌合体。人类神经组织的异种移植几十年来一直用于研究人类疾病120。人类 ESC 的分离和培养、 iPSC 技术的发展以及人类 PSC 经历神经分化甚至移植模型生物的倾向为新型细胞疗法提供了潜力 6,121。当异种移植到发育中的小鼠大脑中时,从人类 iPSC 分化的神经元可以整合、形成功能性突触并整合到神经回路中122。从 iPSC 分化出来的 NSC 将移植到大鼠脑中并分化为神经元和星形胶质细胞,并可能促进缺血性中风模型的恢复123,124。从人类或非人类灵长类 iPSC 分化而来的多巴胺能神经元可以移植到大鼠的大脑中,并改善帕金森病模型的功能125。来自非人类灵长类 iPSC 的多巴胺能神经元也可以自体移植,并在体内长期植入 125。这种功能恢复的令人信服的临床前证据为迫在眉睫的帕金森病的人体临床试验提供了坚实的基础。用于修复海马内神经连接的过继性细胞疗法正在研究用于治疗精神分裂症98。有趣的是,在最近的一项研究中,源自儿童期精神分裂症患者的 iPSC 被分化为胶质前体细胞并异种移植到新生小鼠脑中,在那里它们表现出异常迁移和星形胶质细胞分化 126。最近,描述了源自人类 PSC 的神经类器官的植入,通过宿主脉管系统灌注和神经元活动的电生理学证据,为模拟一系列神经系统疾病提供了一个平台。总之,这些模型证明了嵌合模型在用 iPSC 模拟人类神经系统疾病方面的价值,以及基于 iPSC 的细胞疗法在这些疾病中的可行性。
实体器官嵌合体。人类 iPSC 衍生的类器官已被移植到小鼠体内,以整合血管系统并与正常宿主生理学相互作用70,127。源自人类 iPSC 的肝内胚层细胞可以与培养的内皮和间充质干细胞结合,在那里它们将组织成原始肝芽 70。在异种移植后,这些芽与鼠血管系统形成功能连接,将人白蛋白释放到小鼠血清中并产生人特异性药物代谢物。这些肝芽的移植可以提高肝衰竭小鼠模型的存活率70。从家族性高胆固醇血症患者的 iPSC 分化而来的肝细胞已被异种移植来模拟这种疾病 128。来自 iPSC 的人类肠道类器官在移植到小鼠肾囊下时成熟为肠道组织并形成支持性间充质 127。作为对回盲部切除的反应,移植的肠组织显示出增殖和隐窝裂变的证据,这是对肠切除的全身反应的一部分 127。此外,人类胚胎干细胞可以在分化为胸腺上皮后进行异种移植129,130。最近,研究表明人 iPSC 衍生的 β 细胞可以移植到小鼠胰腺中并分泌人胰岛素 131。
模拟过继免疫。人类 iPSC 已被用于模拟癌症和传染病的过继性 T 细胞疗法,并可能代表用于免疫疗法的无限定制 T 细胞的来源。嵌合抗原受体 T 细胞(CAR T 细胞)被批准用于治疗 B-ALL99。从人 iPSC 分化而来的靶向 CD19 的 CAR T 细胞可有效靶向白血病嵌合模型中的人 CD19+ B-ALL 细胞132。从对 WT1 抗原特异的人类 T 淋巴细胞产生 iPSC,然后分化为细胞毒性 T 细胞并移植到携带 WT1+ 人类白血病的嵌合小鼠中,延长了受体的存活率133。人类黏膜相关的不变 T 细胞可以重编程为 iPSC,分化为 T 细胞谱系并异种移植到小鼠体内,它们可有效对抗脓肿分枝杆菌接种 134。源自人类 iPSC 的 NK 细胞已在疾病的嵌合模型中进行了分析。从人 iPSC 分化的 NK 细胞的过继转移可以抑制 HIV 在体内的复制。来自 iPSC 的 NK 细胞在嵌合模型中具有针对间皮素的 CAR T 细胞靶向卵巢癌细胞 135。总之,这些研究证明了过继免疫的临床前模型在识别潜在的基于免疫细胞的疗法方面的有效性。
结论和展望
我们回顾了过去十年使用人类 iPSC 进行疾病建模的进展,重点介绍了越来越复杂的 3D 类器官系统和嵌合模型,这些模型正被用于发现新的治疗方法。尽管成功地将源自患者的 iPSC 与具有可测量表型缺陷的靶细胞区分开来,但该领域是否已经发展到这些模型具有足够准确性以支持识别影响广泛疾病治疗的新疗法的程度?当我们等待 iPSC 技术对人类健康的影响时,我们认为这一广泛的目标可能仍然超出 iPSC 研究的当前状态。我们警告,在许多系统中,需要进一步细化定向分化,然后才能确认候选干预措施的有效性。造成这种情况的一个原因是人类 iPSC 倾向于分化成具有不成熟的胚胎或胎儿身份,而不是完全成熟的成人状态。根据我们的经验,这一直是iPSC 造血分化建模的一个相当大的障碍,这一点可以从 iPSC 衍生的红细胞中主要表达胚胎和胎儿珠蛋白中得到证明,这阻碍了对成人珠蛋白疾病(如地中海贫血和镰状细胞)的建模疾病106,136。在 iPSC 衍生的肠道类器官 61、心肌细胞 63 和胰腺 β 细胞 62 中也报道了类似的效果。由于生态位衍生信号的整合,将 iPSC 衍生组织植入嵌合体可能会促进成熟61, 70。
第二个挑战是iPSC 系的遗传异质性。对来自大量人群的 iPSC 的研究表明,分化的细胞表型和基因表达存在变异性,这可归因于背景遗传变异 71,72,137,138。尽管可以利用 iPSC 系群来模拟人类遗传异质性 71,72,137,138,但在没有适当控制的情况下,这种效应可能会混淆疾病建模(BOX 2)。患者来源的 iPSC 中引起疾病的突变的遗传校正应用于生成其他同基因对照 iPSC,以用作疾病模型中的对照。
自从首次描述患者来源的 iPSC 以来,模型已经从报告细胞水平输出的单系细胞分化 2D 培养物发展到越来越复杂的 3D 类器官和体内嵌合体,再到现在将紊乱的细胞组织水平和组织-器官水平的相互作用纳入疾病模型。过去几年这项研究的加速支持了我们对基于 iPSC 的模型将继续接近人类多系统疾病的复杂性的持续乐观态度。我们预计,异种移植和类器官技术的进一步进步将有助于克服以自体细胞为基础的治疗道路上的最后障碍,以及iPSC系统中新药物的鉴定(图1)。物种间嵌合体和囊胚互补技术的转化,产生内源性体内形态发生信号指定的嵌合组织,可能会导致未来嵌合疾病模型的进展。此外,iPSC分化方案、类器官系统和嵌合模型的不断改进将拓宽当前基于iPSC的细胞治疗的前沿,有可能彻底改变包括感染性疾病、肿瘤学和组织移植在内的不同学科。
BOX 2 | iPSC 中的人类遗传变异及其对疾病建模的影响 在过去的 30 年中,人类遗传变异已被用作基因组研究的工具,通过定位克隆能够识别疾病相关基因。最近使用大量诱导多能干细胞 (iPSC) 的研究强调了遗传变异对 iPSC 功能和分化的影响。来自不相关的、独立的供体而没有明显疾病表型的 iPSC 已被证明在甲基化谱、基因表达和定向分化效率方面存在差异,这些影响独立于用于重编程的方法而发生 146,147。这些数据强调了在使用 iPSC 进行疾病建模时严格控制的重要性,以避免将疾病表型归因于背景遗传变异,而不是归因于单基因疾病基因中的可疑致病突变(图 2)。
在一项重要研究中,Kilpinen 及其同事分析了来自 301 名健康供体的 700 多个 iPSC 系,从而能够研究个体供体之间和内部的遗传和表观遗传因素的变异 138。通过分析这些细胞系的拷贝数变异、基因表达和蛋白质组学,作者估计 5-46% 的表型变异(包括分化效率)可归因于遗传变异。第二项关键研究对来自不同供体的 215 个 iPSC 系进行了全基因组测序,鉴定了超过 2200 万个单核苷酸变异和超过 15000 个拷贝数变异71。通过使用 RNA 测序,作者报告了影响 4,622 个蛋白质编码基因的数量性状基因座 (QTls) 的存在,其中一些影响转录因子与调控区的结合 71。
Warren 和他的同事 72 利用 iPSC 系之间的遗传变异来功能验证在全基因组关联研究中发现的变体。在这项研究中,作者从弗雷明汉心脏研究中的 34 人的外周血细胞中提取了 68 个 iPSC 系,目的是通过测量与心血管疾病相关的细胞读数来实验验证特定单核苷酸多态性与代谢表型的关联在从 iPSCs72 分化的细胞中。正如预期的那样,iPSCs 分化为肝细胞和脂肪细胞的效率是高度可变的 72。然而,使用代谢组学,作者发现候选 QT1 确实与从这些 iPSC 系分化的细胞中对脂质代谢的影响相关 72。
总的来说,这些研究强调了人类背景遗传变异对 iPSC 中基因表达和分化表型的影响。因此,在疾病模型中,在没有适当的对照 iPSC 系的情况下,应谨慎解释 iPSC 中引发的特定疾病相关表型,例如已修复或补充疑似致病基因缺陷的那些。应努力在疾病建模实验中使用与疾病系尽可能遗传相似的对照 iPSC 系58,59,148,149

