子宫内膜是子宫的重要组成部分之一,为胚胎植入和妊娠维持提供必要的“土壤”。
正常情况下,子宫内膜是一个高度再生的组织,在月经周期中进行动态的,周期性的生长、分化、脱落和再生。
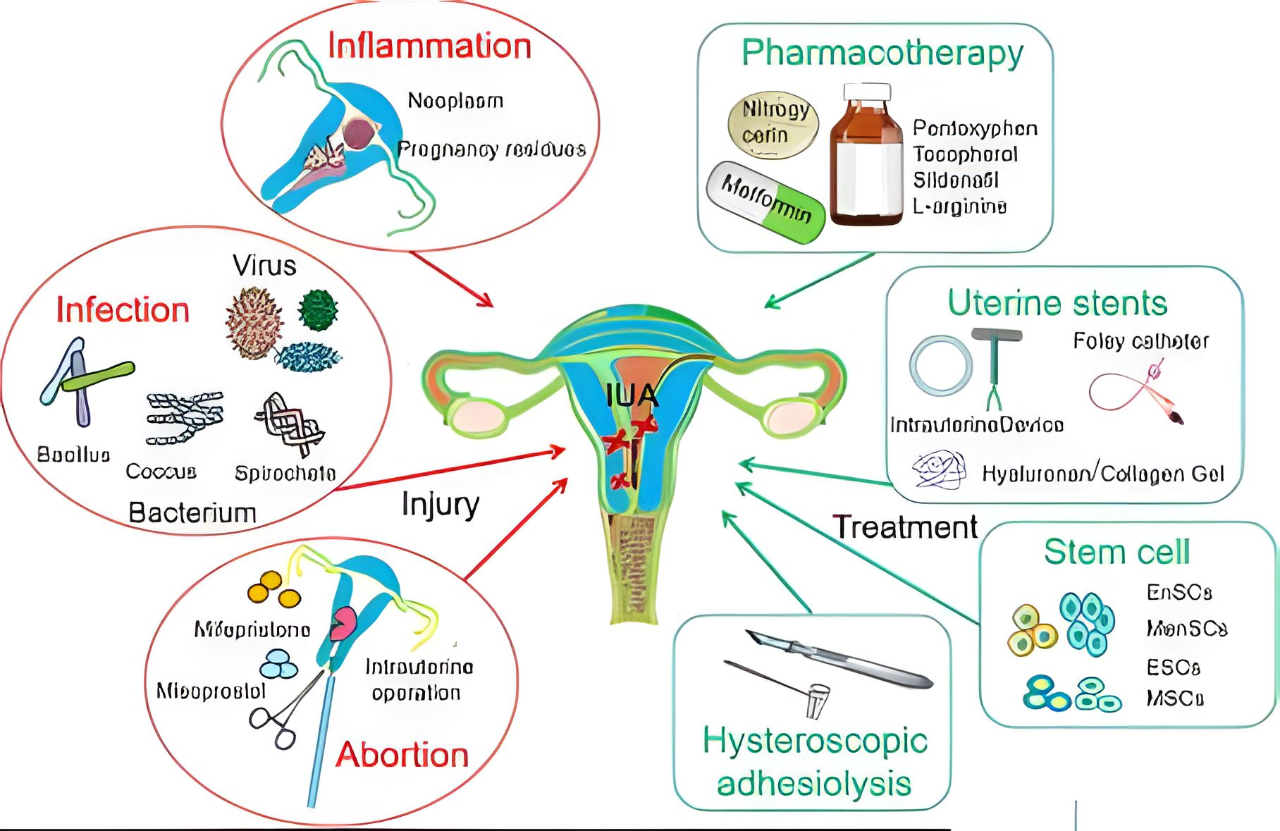
然而,子宫腔操作、感染和炎症都容易使子宫内膜发生严重损伤,再生修复困难,直接导致闭经、不孕、流产或其他严重症状。
早在20世纪70年代,科学家发现骨髓移植后女性患者的子宫内膜中检测到来源于骨髓供体的内膜细胞,由此推测骨髓间充质干细胞可能可以促进子宫内膜组织的再生,此后科学家们不断证实间充质干细胞有能力分化为子宫内膜间质细胞、子宫内膜上皮细胞和子宫内膜血管内皮细胞。
2014年,国内新闻媒体报道了9名重度子宫内膜损伤患者首次接受干细胞修复子宫内膜术,术后5名患者获得妊娠,并且先后已有3名患者成功产下婴儿,这标志着干细胞移植修复子宫内膜具有临床可行性,是世界再生医学领域的重要成果。
从细胞层面来看,子宫内膜损伤发生是由于子宫内膜基质细胞的活力降低,甚至经历细胞凋亡,从而诱导子宫内膜萎缩和子宫内膜稳态的破坏。而子宫内膜损伤激活的细胞凋亡信号通路又抑制了子宫内膜血管生成,进而阻碍子宫内膜再生。
更重要的是,子宫内膜严重损伤通常是不可自然逆转的。
子宫内膜厚度仍是目前临床评价子宫内膜容受性的重要指标!
正常生育年龄女性由于血液中雌、孕激素的影响,子宫内膜的厚度及结构会随月经周期发生显著变化。
雌激素可促进子宫内膜的增生,孕激素可促使子宫内膜发生特殊的妊娠初期变化,或改变子宫内膜的性质,使之具有产生蜕膜的能力。排卵后随着孕激素分泌的增多子宫内膜由增殖期进入分泌期。
增殖期:也就是在月经周期的第5-14天,内膜从0.5mm增厚到3-5mm,有的可以达到8mm;
分泌期:也就是月经周期的第15-28天,内膜厚度可达10mm,个别可达14mm以上。
绝经期:绝经后由于子宫内膜萎缩,内膜厚度<5mm。
所以,您的子宫内膜厚度是否正常,要根据月经周期哪一天做的检查以及是否绝经来判定。下次说自己内膜厚度的时候,一定要加上月经周期。
薄型内膜意味着土壤不够肥沃,这就会失去胚胎种子种植的基础条件。

对于子宫内膜薄的患者来讲,寻找薄型子宫内膜的病因并积极治疗、提高子宫内膜的容受性非常重要。对妨碍胚胎种植的子宫内膜进行预处理,通过治疗使子宫内膜增加至正常厚度,将有助于提高妊娠率及活产率。
临床上,成功修复和重塑子宫内膜的关键因素在于子宫内膜的再上皮化和血运重建,其次,抗感染和炎症控制是优化子宫内膜新生的重要环境保障。但目前仍没有同时满足以上要求的理想的临床治疗方法,手术以及药物治疗都存在一些副作用或疗效甚微。
因此,科学家们不断探索子宫内膜损伤修复的治疗方法,以改善子宫内膜损伤患者的子宫内膜微环境和耐受性状态,从而提高这些患者的妊娠率。
随着技术的不断进步,人们将间充质干细胞附着在可降解的胶原支架材料上,结合宫腔镜技术分离宫腔粘连后,将支架材料和间充质干细胞的复合体移植到宫腔内,使骨髓间充质干细胞的覆盖子宫内膜粘连面,促进了子宫内膜血管组织的再生,术后3个月发现子宫内膜血运良好,实现了受损子宫内膜的功能性修复。
干细胞是一类能够自我更新并具有多向分化潜能的细胞,在体外可分化为特定组织的组成细胞。
按照发生起源,干细胞可分为来自于囊胚内细胞团的胚胎干细胞、来自于新生儿废弃组织的新生儿干细胞(脐血、胎盘、羊膜等间充质干细胞)、来自于成人组织的成体干细胞(脂肪间充质干细胞、骨髓间充质干细胞、神经干细胞等)以及皮肤细胞经诱导重编程形成的诱导多能干细胞等。
干细胞疗法作为许多领域新兴和有前途的疗法,在治疗脑损伤和白血病等各种疾病方面发挥着不可替代的作用。在子宫内膜损伤的治疗研究中,干细胞疗法得到了广泛的应用,在减少子宫内膜纤维化、修复受损子宫内膜、改善子宫内膜接受性方面取得了令人满意的效果。(注:子宫内膜接受性是指子宫具有接受并容纳活性胚胎并成功建立妊娠的能力。)

央视曾报道了用自身间充质干细胞对受损子宫内膜进行修复,从而让不能生育的妇女成功诞下健康婴儿的临床案例。
患者第一次怀孕流产后输卵管梗阻,在当地医院做试管婴儿,但胚胎未能着床。流产清宫后,子宫内膜严重受损。其宫腔四分之三的面积发生粘连,70%的面积瘢痕化。
2013年为该患者实施了宫腔分离手术,同时进行了胶原支架复合自身骨髓干细胞移植,术后复查宫腔镜,宫腔粘连消失,内膜血运良好。2014年患者再次进行了冻胚移植,成功妊娠,并最终顺利产下4.7斤的健康男婴。
该研究为促进干细胞疗法治疗子宫内膜损伤的临床转化应用提供了重要参考。
从脐带血、胎盘、羊膜等间充质干细胞来源广泛,数量充裕,具有良好的免疫容受和成瘤性低的优点,这些来源无创、变废为宝的干细胞可以建立干细胞库,随时满足子宫内膜损伤患者的移植需求。将不仅能大大减轻患者的痛苦,还能缩短手术时间,降低治疗费用。
干细胞是一类具有较强自我更新能力和多方向增殖分化能力的细胞,因此它们可以直接诱导分化并取代受损组织,起到有利的治疗作用,在再生医学和免疫治疗领域具有极大的应用前景。
基于各种动物实验模型及临床实验的研究,发现干细胞修复子宫内膜损伤主要是由于其分化能力,旁分泌活性和免疫调节作用。
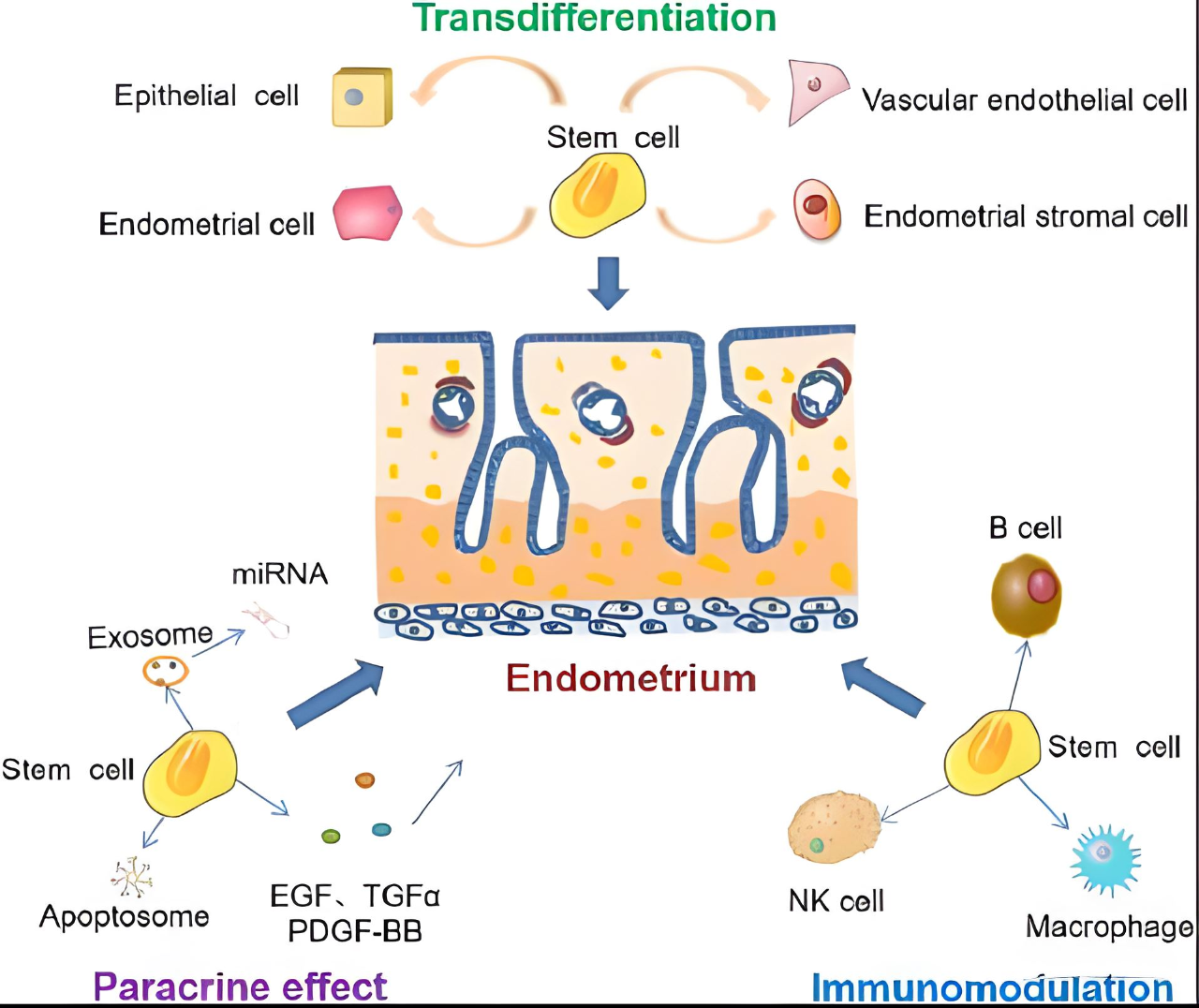
1.干细胞直接分化为功能性细胞
据报道,将间充质干细胞(MSCs)或子宫内膜干细胞移植到IUA患者或雌性大鼠的子宫腔中可以促进子宫内膜再生,这可能是由于干细胞的潜在分化能力。
除了直接分化成子宫内膜细胞外,多能干细胞(PSC)还可以分化成其他细胞,如基质细胞和血管内皮细胞,它们参与子宫内膜修复。
此外,PSC除了分化成功能细胞外,还可以通过分泌细胞因子和趋化因子来调节环境B细胞、NK细胞和巨噬细胞的行为,从而在修复Refs的子宫内膜中发挥作用。
2.干细胞的旁分泌活性和免疫调节作用
干细胞外泌体于20世纪40年代被发现,是直径为30-150nm的膜囊泡,含有蛋白质,脂质,核酸和其他调节生物学功能的关键物质,其生物学功能根据分泌它们的细胞而变化。
研究表明,来自干细胞的外泌体作为旁分泌因子,可以调节受体细胞中相关基因的表达,以实现细胞和组织再生。它们通过改变信号通路、递送miRNA、释放细胞因子或改变功能蛋白来起作用。
例如,间充质干细胞及其衍生的外泌体能够显着增加CK19的表达并减少VIM,TGF-β1,TGF-β1R和Smad2的表达,从而显着增加受损子宫内膜组织中的腺体数量并减少纤维化的面积,从而恢复大鼠受损子宫内膜的功能。
这些外泌体还参与免疫系统的调节,从而调节受损组织的炎症反应以修复子宫内膜。
此外,干细胞产生的生长因子包括表皮生长因子(EGF),转化生长因子(TGF)和血小板生长因子BB(PDGF-BB)也可以发挥旁分泌活性,这可能对干细胞的行为产生协同作用和调节作用。
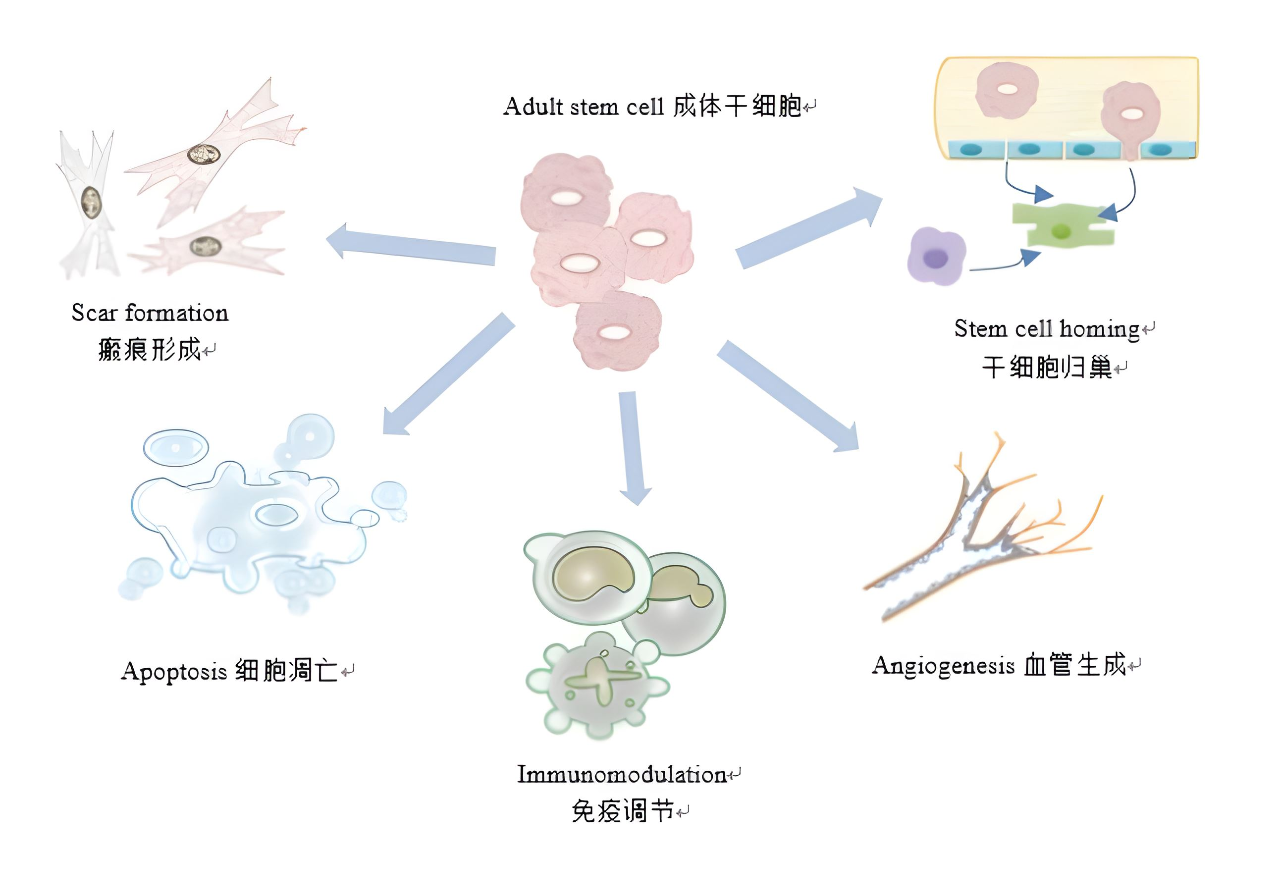
3.干细胞促进组织修复的其他机制
关于干细胞促进组织修复的机制的研究仍在进行中。到目前为止,已经发现了一些新的机制和靶点,如MMP-9和免疫调节。
2018年,北京细胞中心科技美国专家团队发现将脐带间充质干细胞结合生物支架移植到大鼠中,能够通过上调大鼠子宫瘢痕中的MMP-9促进胶原降解,进而促进妊娠率的提高。随着研究的继续,这些机制与靶点将变得越来越清晰。

随着生物技术日新月异的发展,以干细胞治疗为核心的再生医学,已成为继药物治疗、手术治疗后的另一种疾病治疗途径,且具有显著疗效的治疗性手段,为人类疾病的治疗打开了全新的思路,北京细胞中心生物科技技术源头为美国圣地亚哥Aurorae Biolabs实验室,现已将多项培养技术平移到国内,并联合多家三甲医院及实验室共同开展科研合作,在干细胞研究与应用方面已拥有更成熟的经验。
干细胞由于来源丰富、增殖率高、免疫原性低、无伦理问题等优点,在修复子宫内膜损伤方面具有巨大的潜力,目前以干细胞为中心的再生治疗或替代治疗正在不断展开,将为重度子宫内膜损伤的治疗带来新的希望。


