2016年发表在Nature Protocols上的综述文章:展望未来 10 年的诱导多能干细胞技术
Looking to the future following 10 years of induced pluripotent stem cell technologies | Nature Protocols
摘要
诱导多能干细胞 (iPSC) 的发展从根本上改变了我们对发育细胞命运决定的看法,并导致了再生医学的一系列技术创新。在这里,我们概述了过去十年该领域的进展,以及我们对 iPSC 技术未来方向和临床意义的看法。
背景
科学家们在回答哺乳动物生物学中最引人入胜的问题之一方面取得了巨大进展:受精卵如何利用其基因组中编码的遗传信息产生大约 200 种不同的细胞类型。第一个答案出现在 1960 年代,在非洲爪蛙 Xenopus laevis 的一系列范式转换实验中。John Gurdon 爵士使用一种称为体细胞核移植 (SCNT; Box 1) 的技术来证明体细胞的细胞核可以通过去核卵重新编程为能够产生整个有机体的多能状态 1,2。这表明卵子中的细胞质因子可以重新编程体细胞核的命运。在随后的四十年中,该领域见证了一系列重要方法的发展,例如重组 DNA 技术、胚胎干细胞 (ESC; Box 1) 系的建立和功能基因组学,这些方法促进了通过特定因素发现细胞重编程。

BOX1 | 词汇表
SCNT:一种用于发育生物学的技术,可以通过将体细胞核移植到去核卵中来探测体细胞核的发育潜力。
减法 cDNA 杂交筛选(Subtractive cDNA hybridization screen):一种分子生物学方法,它使用放射性标记的 cDNA 探针(在两种细胞类型之间差异表达)来筛选从感兴趣的细胞类型制备的 cDNA 文库。
转分化或直接细胞转化(Transdifferentiation or direct cell conversion:):一个成熟体细胞在不经历正常发育过程的情况下转化为不同谱系的另一个成熟体细胞的过程。
四倍体互补试验(Tetraploid complementation assay):最严格的多能性测试试验,其中二倍体细胞被注射到由细胞融合产生的四倍体囊胚中,以测试它们产生整个胚胎的能力,而四倍体细胞完全变成胚外组织.
Minicircles:环状 DNA 载体,其中细菌来源的质粒骨架通过重组被去除,以避高等真核细胞的细胞免疫。
类器官(Organoids):源自干细胞的 3D 培养中的多细胞结构,其结构和功能类似于器官。
ESC:来自囊胚期胚胎内细胞团的多能细胞。
体细胞(Somatic cells):生物体除了生殖细胞外的任何细胞。
全基因组测序(Whole-genome sequencing):在一个环境中确定生物体基因组的整个 DNA 序列,通常使用高通量测序技术进行
确定的细胞重编程因子
ESC系的建立重塑了发育生物学领域,为研究多能状态3、4提供了便利的实验系统。与青蛙中的 SCNT 相似,去核卵可以重新编程体细胞核,胚胎干细胞可以通过与体细胞(例如成人胸腺细胞和人类成纤维细胞;BOX 1)的融合来重新编程体细胞的表观遗传和转录谱5,6。这一发现表明,ESC 可能是特定重编程因子的肥沃猎场。
其他研究提供了关于重编程因素可能是什么的进一步线索。在许多谱系中证明了两种不同体细胞类型之间的细胞转化,称为转分化(BOX 1)。例如,成肌细胞特异性转录因子 (TF) MyoD 通过消减 cDNA 杂交筛选(BOX 1)鉴定。
单独 MyoD 的异位表达足以将小鼠成纤维细胞转化为成肌细胞。同样,在造血谱系中,单个主要细胞命运决定 TF被证明就已足以诱导转分化8,9,例如 GATA1 或 C/EBPs。这些发现表明,TFs可以指导细胞命运和分化。
通过 TF 进行重编程。正是在这些先前研究的背景下,Shinya Yamanaka 及其同事开展了最终导致 iPSC 创新的开创性工作。关键的第一步是确定能够将终末分化细胞重编程为多能细胞的因子,多能细胞的特征在于具有无限期自我更新的能力和分化成体内任何细胞类型的潜力。潜在的重编程因子的选择是基于这样的假设,即维持 ESC 所必需的因子在体细胞的核重编程中也具有重要作用。Yamanaka 小组在计算机和实验上都表征了在 ESC 中特别富集的 cDNA。这些 ESC 相关转录物 (ECAT) 被选为候选重编程因子。研究人员使用敲除 ESC 和敲除小鼠分析了这些 ECAT。例如,他们表明 ECAT NANOG 可以独立于 LIF-STAT3 信号 10 维持 ESC 自我更新。几个不一定在 ESC 中特异性表达但对维持多能性至关重要的基因也被选为候选基因 11-13。
最后的 24 个候选者被包装为逆转录病毒表达载体,并转导到小鼠胚胎成纤维细胞中,以测试它们诱导多能性的能力 14。尽管没有单一的候选因子产生 ESC 菌落,但所有 24 个因子的集合可重复性地产生 ESC 样细胞克隆。通过系统地一次消除一个因素,科学家们确定了四个关键因素——即 OCT4(也称为 POU5F1)、SOX2、KLF4 和 MYC(称为 Yamanaka 因子)——当在体细胞中异位表达时可以诱导多能性14 。不久之后,同一团队证明Yamanaka 因子可以从人类细胞中产生 iPSCs15,16。与此同时,James Thomson 及其同事使用包括 NANOG 和 LIN28 而非 KLF4 和 MYC17 在内的重编程因子的替代组合独立地获取了人类 iPSC。十年后,这些相同的重编程因子(OCT4、SOX2、KLF4、MYC、NANOG 和 LIN28)仍然是 iPSC 领域的基石,这表明了原始工作的稳健性(图 1)。与许多重大发现一样,事后回顾 iPSC 的发展可能会给人一种可预测性和必然性的错误感觉。iPSC 的出现可以看作是类似于中国古典小说《西游记》中关于孙悟空诞生的意象:孙悟空从岩石中破土而出,并凭借他神奇的长生不老的力量(自我更新)和变形(多能性),他永远改变了世界。
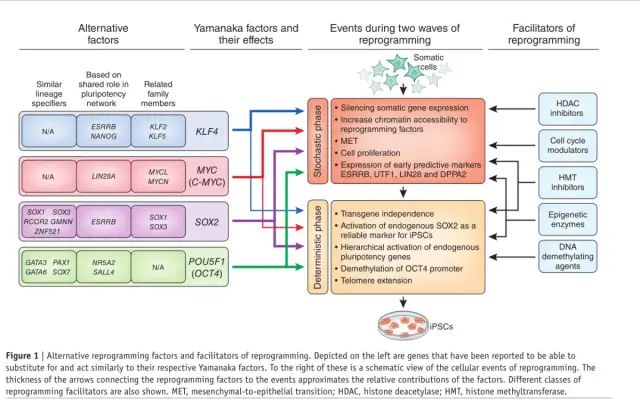
图 1 | 替代重编程因子和重编程促进因子。左侧描绘的是据报道能够替代它们各自的山中因子并与之相似的基因。右侧是重编程的细胞事件的示意图。将重编程因子与事件连接起来的箭头粗细近似于因子的相对贡献。还显示了不同类别的重编程促进剂。MET,间充质-上皮转化;HDAC,组蛋白脱乙酰酶;HMT,组蛋白甲基转移酶。
iPSC 的特征和重编程技术的开发
在发现 iPSC 后,确定这些细胞与“黄金标准”ESC 的相似程度非常重要。转录谱、表观遗传图谱和分化潜能的比较证实了 iPSC 和 ESC 之间的显著相似性,但关于两种细胞类型之间细微差异的程度和重要性的争议仍然存在(参见参考文献 18)。不同研究得出的结论有些模棱两可,这可能是由于遗传背景、重编程方法和培养条件的差异造成的。事实上,严格匹配的同基因型(isogenic)小鼠 iPSC 和 ESC只有两个差异表达的转录本,位于印记的 Dlk1-Dio3 基因位点。在功能上,Dlk1-Dio3 基因座的印记状态可以说是小鼠 iPSC20,21 体内发育能力的最佳预测因子。与以原始多能性状态(称为naive幼稚多能性)存在的小鼠 iPSC 或 ESC 不同,人类 iPSC 对应于发育更进一步的多能性状态(称为primed始发多能性),因此目前尚不清楚高质量小鼠naive的标记是否iPSCs 也适用于primed的人类 iPSCs。尽管尚未了解 iPSC 和 ESC 之间报告的分子差异的生物学意义,但 iPSC 已被证明能够进行种系传播 22-24 甚至在四倍体互补试验中产生“全 iPSC”小鼠(BOX 1),这是最严格的发育能力测定方法25-27。这些数据应该消除了对小鼠 iPSC 和 ESC 在发育潜力和多能性方面的等效性的任何挥之不去的怀疑。
iPSCs 在研究核重编程机制、疾病建模、药物筛选和自体细胞治疗方面的价值立即得到认可。然而,细胞重编程的低效率是阻碍该领域进展的瓶颈。此外,用于传递重编程因子的逆转录病毒在整个 iPSC 基因组中产生了多个整合转基因拷贝,从而增加了基因组毒性的风险。病毒转基因的不当表达会偏向 iPSCs 的分化潜能,并导致嵌合小鼠肿瘤的高发病率22, 28。这些问题可能会混淆机制研究并危及 iPSC 在临床应用中的安全性。因此,改进iPSC 重编程的效率、基因组完整性和安全性是研究人员的首要任务。
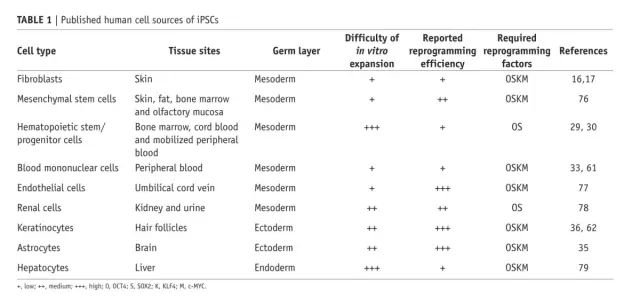
iPSC 的体细胞来源。已经付出了很多努力来扩大细胞来源的种类。这样做的原因包括希望了解重编程机制、优化 iPSC 生成和模型疾病。能够产生 iPSC 的体细胞列表不断增长,以匹配体内发现的所有细胞类型。示例范围从血液 29、30 和大脑 31、32 的体干细胞到终末分化淋巴细胞 33 和出生后神经元 34。重编程所需的效率、动力学和因子在不同细胞类型之间差异很大(TABLE 1)。例如,人类角质形成细胞和星形胶质细胞的高效重编程归因于它们在基因表达程序、细胞周期特征和上皮表型方面与 ESC 非常相似35、36。此外,由于其他 Yamanaka 因子的补偿性内源性表达,一些成体干细胞可以用少至一个因子(例如,神经干细胞的 OCT4)进行重编程30-32。消除使用可能致癌的 MYC 进行重编程可能会使成体干细胞成为未来高质量 iPSC 的有吸引力的来源。从这些研究中得出的主要结论是,重编程过程取决于细胞环境,诱导多能性是适用于不同细胞类型的普遍现象。
非整合的 iPSC。第一代逆转录病毒重编程载体的成功在于其能够向广泛的细胞类型进行有效递送以及Yamanaka 因子的持久高水平表达。这两个特征都是在没有表达载体整合的情况下成功重编程的先决条件,其目的是取代病毒整合。使用可切除的多顺反子慢病毒载体使得可以从已建立的 iPSC 中去除转基因。然而,在切除事件后留下了一个小的基因组足迹,因此这种方法并不是严格的非整合 37,38。真正的非整合 iPSC 是用非整合病毒产生的,包括在细胞中瞬时表达重编程因子的腺病毒和仙台病毒33、39、40。此外还开发了其他非病毒方法,包括使用质粒、Minicircles(BOX 1)和游离型载体,以及合成 mRNA、microRNA 和重组蛋白的表达(参见参考文献 41 的综述)。
替代重编程的方法。对多能性调控网络和重编程机制的研究产生了新的重编程因子和提高重编程效率的小分子。新因子是根据它们替代现有重编程因子或促进重编程的能力来确定的。同一 TF 家族的相关成员可以激活相同的基因表达程序,因此可以相互替代。例如,Krüpple TF 家族(例如 KLF2 和 KLF5)和 MYC 家族(例如 N-MYC 和 L-MYC)的其他成员可以分别替代 KLF4 和 MYC42-44。不同的因子也可以激活相同的多能性途径,就像 Lin28 的情况一样,它通过抑制其负调节因子 let-7 microRNA 来促进 MYC 翻译。同样,ESRRB 受 KLF4 的转录调控,可以在重编程中取代它45,46。
值得注意的是,邓宏魁团队在一系列论文中表明,一组核心小分子(即丙戊酸( valproic acid)、CHIR99021、E-616542、反苯环丙胺、毛喉素( tranylcypromine, forskolin)和 DZNep)足以将所有三个胚层的多种细胞类型重新编程为多能性细胞,从而避免了基因操作的需要47,48。有趣的是,化学重编程通过胚外内胚层样阶段过渡,而不是像Yamanaka因子诱导的通过原始条纹样中内胚层中间体过渡。如果这一新方法被证明是可靠的,它可能会带来更一致和标准化的iPSC生产。然而,有必要进行进一步的研究,以评估用化学物质取代遗传物质是否提高了iPSCs的安全性,以及是否有可能用类似的鸡尾酒对人类细胞进行重新编程。
重编程各阶段。科学家们通过研究重编程过程中的分子事件并了解重编程的障碍,发现了其他重编程促进因素。现在普遍认为重编程经历了两个“波”。在第一波中,Yamanaka 因子结合许多基因组位点以沉默定义体细胞身份的基因,同时它们激活促进细胞周期、DNA 复制和间充质到上皮转化的基因。此步骤是随机的且效率低下,主要是由于组蛋白的表观遗传修饰使染色质无法被接近。ESRRB、UTF1、LIN28 和 DPPA2等几种标志物的表达可预测此阶段完全重编程的细胞。在这个早期阶段之后,处于部分重编程状态并表达早期多能性标志物(例如碱性磷酸酶和 FBXO15)的细胞进入第二阶段,其中内源性多能性基因网络以更具确定性和层次性的方式建立。DNA 甲基化的变化仅发生在重编程的后期,这可能有助于加强多能性的表观遗传状态50,51。调节表观遗传酶如 WDR5(H3K4 甲基化)、DOT1L(H3K79 甲基化)和 TET1(DNA 去甲基化)的表达已被证明可促进 Yamanaka 因子在早期或晚期的作用,从而提高重编程效率52 ,53。使用小分子也可以达到相同的效果,例如组蛋白去乙酰化酶抑制剂(例如丁酸钠和丙戊酸)、组蛋白甲基转移酶抑制剂(例如用于 H3K9 甲基转移酶 G9a 的 BIX-01294)和 DNA 去甲基化剂(例如 5-氮杂-胞苷)54(图 1)。
抑制 iPSC 的细胞衰老。与在培养中无限期快速增殖的 ESC 不同,体细胞只具有有限增殖潜力并且容易发生细胞衰老。要成为 iPSC,体细胞需要克服细胞衰老,这是由肿瘤抑制因子 p53、p21(也称为 CDKN1A)和 INK4A/ARF(也称为 CDKN2A)调节的。特征性 ESC 样细胞周期特征出现在重编程的早期。通过抑制 p53 和细胞周期依赖性激酶抑制剂(p21、INK4A/ARF)或通过细胞周期增强剂(细胞周期蛋白 D1、D2 和 E2)的过表达来诱导细胞增殖,提高重编程效率,而细胞周期停滞会抑制重编程过程55-58。有趣的是,使用短发夹 RNA (short hairpin RNA)暂时抑制 p53 不仅提高了正常细胞的重编程效率,而且还能够从难以重编程的细胞中生成 iPSC。例如,范可尼贫血 (FA) 患者的细胞在常氧条件下对 Yamanaka 因子的重编程具有抵抗力,因为 FA DNA 修复途径的缺陷会显著降低重编程效率。使用短发夹 RNA抑制重编程中 p53 介导的 DNA 损伤反应,可以产生核型正常的人类 FA iPSC 60。
由于这些热情的努力,现在可以使用许多强大的方案来从血液、头发和皮肤等容易获得的样本中提取人类 iPSC,这对生物医学研究和大规模 iPSC 业务都是一个福音29、61、62。
转分化。iPSC技术的快速发展也刺激了使用定义的因子将一种分化的细胞类型直接转化为另一种细胞类型(也称为转分化)的研究。直接细胞转化不涉及多能性步骤,因此原则上它可以避免多能性相关的肿瘤发生。然而,转分化通常不允许最终产品的扩张,而且它往往效率较低。目前正在进行积极的研究以提高这一令人兴奋的技术的治疗潜力(有关综述,请参阅参考文献63)。
iPSC 技术在再生医学中的未来
iPSC 技术的快速发展激发了许多令人兴奋的研究领域,包括临床相关细胞类型的定向分化、疾病建模、药物筛选和细胞治疗。与历史上的重大技术突破一样,iPSC 技术促进了许多相关的创新。一个这样的例子是 3D 类器官的开发(BOX 1),它提供了急需的人类发育、体内平衡和疾病的近生理模型 64。因此,在iPSC产生的第一个十年里,再生医学领域已经成为一个高度活跃的研究领域(图 2)。
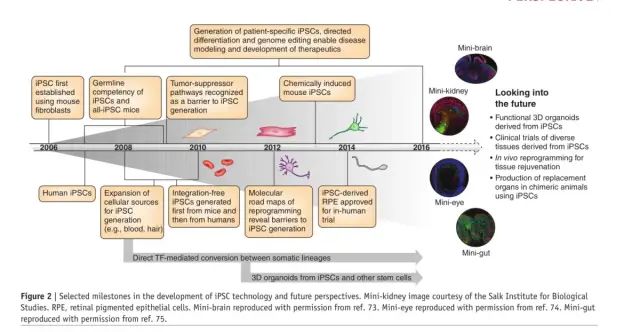
图 2 |选定的 iPSC 技术发展里程碑和未来展望。迷你肾脏图片由 Salk 生物研究所提供。RPE,视网膜色素上皮细胞。经参考许可复制的迷你大脑73. 经参考许可复制的迷你眼74. 经参考许可复制的小肠75.
临床试验中的 iPSC。2014 年,在日本一项针对年龄相关性黄斑变性的临床试验中,第一例患者接受了 iPSC 衍生的视网膜色素上皮细胞移植,该试验旨在评估基于 iPSC 的细胞疗法的安全性和有效性,这是同类试验中的首例。令人鼓舞的是,到目前为止,还没有关于不利影响的报告。这代表了实现 iPSC 临床潜力的重要第一步。类似的有前途的途径包括 iPSC 衍生的心脏细胞和神经系统细胞,其中存在强大的分化方案65,66。除了用作心肌梗塞和帕金森病等疾病的细胞疗法外,这些细胞还可用于对新药进行更准确的毒性评估,从而大大降低药物开发的成本和失败率67。
展望未来,研究人员将需要与医生和监管机构密切合作,以解决许多重要问题,然后才能充分利用 iPSC 的潜力。该领域尚未就 iPSC 临床使用的安全标准达成共识。几项研究报告了 iPSC 中存在突变,尽管突变的来源和意义仍存在争议 68-70。如果全基因组测序(WGS;BOX1)是强制性的,以避免使用带有突变的 iPSC,就像上一段中提到的日本的试验一样,基于 iPSC 的治疗的成本可能会变得过高。即使成本不是问题,更多的 WGS 数据也不一定能提供明确的答案,因为大多数基因组的功能目前尚不清楚。例如,基因组中有约 500 个超保守元素(非编码),功能不明确 71。很难预测这些元素突变的后果。因此,我们对 iPSC 突变负荷对其治疗用途的影响的理解将与功能基因组学共同发展。值得注意的是,其他移植细胞(例如骨髓)不需要 WGS。需要更多的基础研究工作和临床试验来制定监管指南,以平衡基于 iPSC 的治疗的收益、风险和成本。
iPSC 的移植。我们所未知的另一个主要问题是是移植细胞的哪些属性最能预测其治疗功能。大多数定向分化方案侧重于产生细胞表型与其体内终末分化对应物相匹配的细胞。关于移植后这些细胞会发生什么,人们知之甚少,而且还有许多问题。例如,在没有内源性生态位的情况下,体外产生的细胞能否在移植后存活并在功能上整合?表型校正需要多少个细胞?是否存在未成熟的、正在增殖的祖细胞比终末分化细胞提供更多优势的情况?移植的一个有趣的替代方法是通过体内重编程或转分化产生所需的细胞类型,如小鼠模型中的大脑和心脏所示 69,72。然而,需要仔细研究在体内引入强大的命运决定性 TF 的长期影响。未来旨在回答这些问题的研究对于弥合 iPSC 的基础科学和医疗用途之间的差距是必要的。
总结
过去十年的研究清楚地表明,细胞重编程为多能性是一项快速发展的技术,在临床应用方面具有很大的前景。同样明显的是,为了充分发挥 iPSC 的潜力,仍然需要付出很多努力。这将需要增加基础研究并与临床医生和政策制定者进行更密切的合作。科学界应向公众宣传 iPSC 在未来医学中的效用,同时小心防范不切实际的期望。在广大公众的理解和支持下,我们应该期待在不远的将来,借助 iPSC 技术揭示疾病机制,批准个性化治疗并发现更多有用的药物。
上一篇:干细胞对于疾病有哪些改善作用?
下一篇:宫内膜干细胞由何而来?

